
分析 同温同压下气体摩尔体积相同,则同体积的二者具有相同的物质的量,再利用构成来计算原子总数之比,利用m=nM来计算质量之比,据此进行解答.
解答 解:因同温同压下,同体积的气体具有相同的分子数,则具有相同的物质的量,则N2和SO2的物质的量之比为1:1;
二者含有原子总数之比=1×2:1×3=2:3,
摩尔质量之比为28g/mol:64g/mol=7:16,二者质量之比=1×7:1×16=7:16,
故答案为:1:1; 2:3; 7:16.
点评 本题考查阿伏伽德罗定律及其推论,题目难度不大,明确相同温度和压强下气体的体积与物质的量的关系及物质的构成即可解答,并应熟悉常见气体的摩尔质量来解答.


科目:高中化学 来源: 题型:实验题
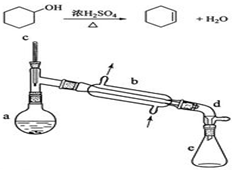 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环已醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环已烯 | 82 | 0.8102 | 83 | 难溶于水 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用可见光束可以鉴别红褐色的氢氧化铁胶体和溴水,是因为溶液与胶体的本质区别是能否发生丁达尔效应 | |
| B. | 分散系是一种物质分散到另一种物质中形成的混合体系 | |
| C. | 氢氧化铁胶体具有吸附性,能吸附水中悬浮颗粒并沉降,因而常用于净水 | |
| D. | 淀粉溶液和蛋白质溶液是溶液,不可能是胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 | |
| B. | 向水中加入氨水,平衡逆向移动,c(OH-)降低 | |
| C. | 向水中加入金属钠,平衡正向移动,c(H+)增大 | |
| D. | 将水加热,KW增大,pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三上第二次模拟化学试卷(解析版) 题型:实验题
某学生欲配制6.0mol/L的H2SO4溶液1000mL,实验室有三种不同浓度的硫酸:①480mL0.5mol/L的硫酸;②150mL25%的硫酸(ρ=1.18g/mL);③足量的18mol/L的硫酸。有三种规格的容量瓶:250mL、500mL、1000mL。老师要求把①②两种硫酸全部用完,不足的部分由③来补充。
请回答下列问题:
(1)实验所用25%的硫酸的物质的量浓度为 mol/L (保留1位小数)。
(2)配制该硫酸溶液应选用容量瓶的规格为 mL。
(3)配制时,该同学的操作顺序如下,请将操作步骤B、D补充完整。
A.将①②两溶液全部注入烧杯中混合均匀;
B.用量筒准确量取所需的18mol/L的浓硫酸 mL,注入上述混合液中。并用玻璃棒搅拌,使其混合均匀;
C.将混合均匀的硫酸沿玻璃棒注入所选的容量瓶中;
D. ;
E.振荡,继续向容量瓶中加水,直到液面接近刻度线1~2cm处;
F.改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切;
G.将容量瓶盖紧,振荡,摇匀。
(4)如果省略操作D,对所配溶液浓度有何影响? (填“偏大”、“偏小”或“无影响”)。
(5)进行操作C前还需注意 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com