
| A. | 只有④ | B. | 只有⑤ | C. | ①②③④⑤ | D. | ①②③ |
分析 比较元素的非金属性强弱,可从与氢气反应的剧烈程度、氢化物的稳定性、最高价氧化物对应水化物的酸性强弱等角度判断,注意不能根据得失电子的多少以及熔沸点的高低等角度判断.
解答 解:①甲比乙容易与H2化合,可说明甲比乙的非金属性强,故①正确;
②甲单质能与乙阴离子发生置换反应,说明甲单质比乙单质的氧化性强,单质的氧化性越强,对应的元素的非金属性越强,故②正确;
③甲的最高价氧化物对应的水化物的酸性比乙的最高价氧化物对应的水化物酸性强,可说明可说明甲比乙的非金属性强,故③正确;
④与某金属反应时甲原子得电子数目比乙的多,不能说明可说明甲比乙的非金属性强,非金属性的强弱只与等电子的能力有关,故④错误;
⑤甲的单质熔沸点比乙的低,属于物理性质,与得失电子的能力无关,不能用来判断非金属性的强弱,故⑤错误,
故选D.
点评 本题考查元素的非金属性的强弱比较,题目难度中等,本题注意正确比较非金属性的角度.


科目:高中化学 来源: 题型:选择题
| A. | 该溶液中溶剂与溶质的质量比为m(水):m(溶质)=( $\frac{18na}{M}$+b):(a-$\frac{18na}{M}$) | |
| B. | 该溶液的物质的量浓度为c=$\frac{1000a}{MV}$mol•L-1 | |
| C. | 该溶液中溶质的质量分数为ω=$\frac{100a(M-18n)}{a+b}$% | |
| D. | 该溶液的密度为ρ=$\frac{1000(a+b)}{V}$g•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2NaBr+Cl2═2NaCl+Br2 | |
| B. | AlCl3+3NaAlO2+6H2O═4Al(OH)3↓+3NaCl | |
| C. | 2H2S+SO2═2H2O+3S↓ | |
| D. | C+CO2$\frac{\underline{\;高温\;}}{\;}$2CO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
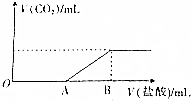 标准状况下,向100mL NaOH溶液中缓慢通入一定量的CO2气体,充分反应后,测得所得溶液M的pH>7(反应前后溶液的体积变化忽略不计),在溶液M中逐滴缓慢滴加1mol•L-1 的盐酸,所得气体的体积与所加盐酸的体积关系如图所示,已知图中B点的位置固定,V(B)=300mL,而A点可在横坐标中自由移动.
标准状况下,向100mL NaOH溶液中缓慢通入一定量的CO2气体,充分反应后,测得所得溶液M的pH>7(反应前后溶液的体积变化忽略不计),在溶液M中逐滴缓慢滴加1mol•L-1 的盐酸,所得气体的体积与所加盐酸的体积关系如图所示,已知图中B点的位置固定,V(B)=300mL,而A点可在横坐标中自由移动.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1-丁烯 | B. | 2-丁烯 | C. | 1,3-丁二烯 | D. | 1-丁炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
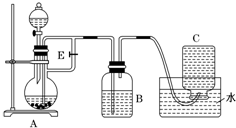 如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化.实验时必须使用铁屑、6mol•L-1硫酸溶液,其他试剂任选.填写下列空白:
如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化.实验时必须使用铁屑、6mol•L-1硫酸溶液,其他试剂任选.填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:HCl>HBr>HI | B. | 原子半径:Na>Mg>Al | ||
| C. | 还原性:PH3>H2S>HC1 | D. | 结合H+能力:CH3COO->HCO3->ClO- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com