

 .
. ,E中含氧官能团的名称为羧基.
,E中含氧官能团的名称为羧基. .
. .
. 分析 M分子式为C8H8,核磁共振氢镨显示M有5种化学环境的氢,则M为苯乙烯;从分子式可以看到A比M 多了两个氢原子和一个氧原子,故发生的反应为M与H2O的加成反应得A,A发生氧化反应得B,根据B的结构可知A为 ,C发生信息②中的反应得D为
,C发生信息②中的反应得D为 ,D在浓硫酸作用下发生消去反应得E为
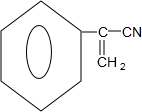
,D在浓硫酸作用下发生消去反应得E为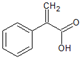 ,E发生取代反应生成F为
,E发生取代反应生成F为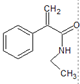 ,F发生加聚反应得G,根据K到苯乙酸乙酯的合成过程,可以用倒推的方法进行推测:苯乙酸乙酯有乙醇和苯乙酸酯化反应得到,故J为苯乙酸,J由I酸化得到,故I为苯乙酸盐,可以推测得到在反应II中应为在碱性条件下的氧化反应,H为苯乙醛,则K为苯乙醇,反应条件I为苯乙醇的氧化反应,据此答题;
,F发生加聚反应得G,根据K到苯乙酸乙酯的合成过程,可以用倒推的方法进行推测:苯乙酸乙酯有乙醇和苯乙酸酯化反应得到,故J为苯乙酸,J由I酸化得到,故I为苯乙酸盐,可以推测得到在反应II中应为在碱性条件下的氧化反应,H为苯乙醛,则K为苯乙醇,反应条件I为苯乙醇的氧化反应,据此答题;
解答 解:(1)M分子式为C8H8,核磁共振氢镨显示M有5种化学环境的氢,M中含有苯环,故应为苯乙烯;D为 ,D在浓硫酸作用下发生消去反应得E为
,D在浓硫酸作用下发生消去反应得E为 ,含有的官能团为羧基,
,含有的官能团为羧基,
故答案为:苯乙烯; ;羧基;
;羧基;
(2)根据上面的分析可知,B发生加成反应生成C,F为 .在F中含有碳碳双键,发生加聚反应得到G,
.在F中含有碳碳双键,发生加聚反应得到G,
故答案为:加成反应;加聚反应;
(3)由M生成A的化学方程式为
故答案为: ;
;
(4)B的同分异构体中只含苯环一个环状结构且遇FeC13溶液不显色说明在这些同分异构体中不含有酚羟基,故可能的结构为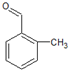 、
、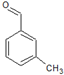 、
、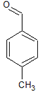 、
、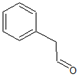 、
、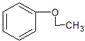 ,共5种,其中核磁共振氢镨为四组峰,且峰面积之比为3:2:2:1的结构简式为
,共5种,其中核磁共振氢镨为四组峰,且峰面积之比为3:2:2:1的结构简式为 ,
,
故答案为:5; .
.
点评 本题考查有机物的推断与合成,难度中等,根据官能团的性质顺推进行推断,注意掌握官能团的性质与转化.


科目:高中化学 来源: 题型:解答题

| 锂 | X | |
| 失去第一个电子(I1) | 519 | 580 |
| 失去第二个电子(I2) | 7296 | 1820 |
| 失去第三个电子(I3) | 11799 | 2750 |
| 失去第四个电子(I4) | 11600 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于吸热反应,由于吸收热量后反应体系的温度升高 | |
| B. | 对于吸热反应,生成物的总能量,高于反应物的总能量 | |
| C. | 对于放热反应,放出热量后反应体系的温度降低 | |
| D. | 对于放热反应,生成物的总能量高于反应物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大于52% | B. | 等于52% | C. | 小于52% | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色气体,原物质一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入稀盐酸后再加入硝酸银,产生白色沉淀,则原溶液一定有Cl- | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,不一定有Ba2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com