
| A. | SO2 | B. | H2 | C. | HCl | D. | NH3 |
分析 浓硫酸具有酸的通性、吸水性.脱水性和强氧化性,所以浓硫酸不能干燥具有碱性、还原性的气体.
解答 解:A.二氧化硫为酸性气体,可以用浓硫酸、五氧化二磷或无水氯化钙干燥,故A错误;
B.氢气为中性气体,可用浓硫酸、五氧化二磷、无水氯化钙或碱石灰干燥,故B错误;
C.HCl为酸性气体,可以用浓硫酸、五氧化二磷或无水氯化钙干燥,故C错误;
D.氨气为碱性气体,不能用浓硫酸干燥,可用碱石灰干燥,故D正确.
故选D.
点评 本题考查气体除杂问题,水蒸汽的吸收比较复杂,中性气体可用浓硫酸、五氧化二磷、无水氯化钙或碱石灰干燥;酸性气体可用浓硫酸或五氧化二磷或无水氯化钙干燥,碱性气体NH3碱石灰干燥;能被浓硫酸氧化,能被碱石灰吸收的还原性气体一般用五氧化二磷或无水氯化钙干燥,题目难度不大.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:解答题
| 1 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
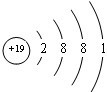 .
.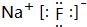 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
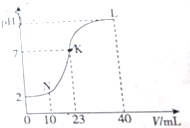
| A. | K点时的溶液:n(A-)=n(M+)=2×10-4 mol | |
| B. | N点时的溶液:2c(M+)=c(A-) | |
| C. | L点时的溶液中一定存在:c(M+)>c(A-)>c(OH-)>c(H+) | |
| D. | 水电离的程度:K>L>N |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LSO3所含电子数约为40NA | |
| B. | 0.5molNH4HSO4晶体中,含有H+数目约为0.5NA | |
| C. | 48gO2,O3混合气体含有的氧原子数为3NA | |
| D. | 1molCl2作为氧化剂得到的电子数一定为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2-淡黄色固体,可用作漂白剂 | B. | Na2O-白色固体,溶于水生成NaOH | ||
| C. | NaOH-性质稳定,可治疗胃酸过多 | D. | NaHCO3-受热易分解,可用作发酵粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y元素为Na元素 | B. | X只能位于第3周期 | ||
| C. | a+n-b+m=10或16 | D. | Y不可能位于第2周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KCl、NaOH | B. | CO2、HCl | C. | CaCl2、NH4NO3 | D. | Na2O2、H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其钠盐的化学式为Na2X | B. | 最高价氧化物对应水化物为碱 | ||
| C. | X是金属元素 | D. | X单质是能导电的固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 反应方程式 |
| 1.将少量氯水加入盛有NaBr溶液的试管中,用力振荡后加入少量四氯化碳,振荡、静置 | 上层为浅黄色(或无色) 下层为橙色 | 离子方程式: Cl2+2Br-=Br2+2 Cl- |
| 1.将少量溴水加入盛有NaI溶液的试管中,用力振荡后加入少量四氯化碳,振荡、静置 | 上层为浅黄色(或无色) 下层为紫红色 | 化学方程式: Br2+2NaI=I2+2NaBr |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com