
常温时,0.01 mol·L-1某一元弱酸的电离常数Ka=10-6,则下列说法正确的是
A. 上述弱酸溶液的pH=4
B. 加入NaOH溶液后,弱酸的电离平衡向右移动,K值增大
C. 加入等体积0.01 mol·L-1NaOH溶液后,所得溶液的pH=7
D. 加入等体积0.01 mol·L-1NaOH溶液后,所得溶液的pH<7
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源:广东省2016-2017学年高一上学期期末考试化学试卷 题型:选择题
对Ⅰ~Ⅳ的实验操作现象判断正确的是

A. 实验Ⅰ:产生红褐色沉淀 B. 实验Ⅱ:溶液颜色变红
C. 实验Ⅲ:放出大量气体 D. 实验Ⅳ:先出现白色沉淀,后沉淀又溶解
查看答案和解析>>
科目:高中化学 来源:2017届陕西省榆林市高考模拟第一次测试理综化学试卷(解析版) 题型:推断题
有机物A有如图所示的转化关系:
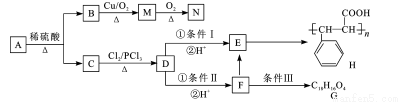
已知:①有机物B是芳香烃的含氧衍生物,其相对分子质量为108,B中氧的质量分数为14.8%;
②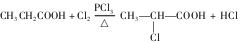
③G分子结构中含有3个六元环。
根据以上信息,回答下列问题:
(1)有机物F中官能团的名称是__________
(2)A的名称是___________
(3)条件Ⅲ为_____;F G的反应类型为_______,G的结构简式为__________。
G的反应类型为_______,G的结构简式为__________。
(4)写出一种检验M中官能团的化学方程式____________
(5)R是N的同系物,相对分子质量比N大14,R有多种同分异构体,则同时符合下列条件的同分异构体有___种,其中核磁共振氢谱为4组峰,且峰面积之比为3:2:2:1的有机物结构简式为____。
a.含由苯环 b.能发生银镜反应 c.遇FeCl3溶液不显紫色 d.不含醚键
(6)写出下列转化的化学方程式:F E__________________
E__________________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高二下学期开学考试化学试卷(解析版) 题型:选择题
对于可逆反应:2M(g)+N(g) 2W(g),分别测定反应在不同温度下达到平衡时N的转化率,绘制了下图所示的曲线,图中a、b、c三点分别表示不同的时刻状态,下列分析正确的是( )
2W(g),分别测定反应在不同温度下达到平衡时N的转化率,绘制了下图所示的曲线,图中a、b、c三点分别表示不同的时刻状态,下列分析正确的是( )
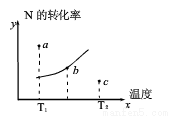
A. 该反应的ΔH<0
B. b点时混合气体的平均摩尔质量不再变化
C. 增大压强,可使a点达到T1温度下平衡状态
D. c点表示的状态:v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高二下学期开学考试化学试卷(解析版) 题型:选择题
在恒温、恒压下,a mol A和b molB在一个容积可变的容器中发生反应:A(g) +2B(g) 2C(g),一段时间后达到平衡,生成n mol C。下列说法正确的
2C(g),一段时间后达到平衡,生成n mol C。下列说法正确的
A. 物质A、B的转化率之比为l:2
B. 起始时刻和达到平衡后容器中的压强之比为(a+b):(a+b-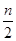 )
)
C. 当v正(A)=v逆(B)时,反应一定达到平衡状态
D. 充入惰性气体,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高二下学期开学考试化学试卷(解析版) 题型:选择题
常温下,将少量水加入下列物质中,相关量变化正确的是
A. AgCl悬浊液中 c(Cl-)变小 B. 0.1mol/LCH3COOH溶液中 c(H+)变小
C. 0.1mol/LNa2CO3c(HCO3-)变大 D. 0.1mol/LNH4Cl溶液中 n(OH-)变小
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高一下学期第一次模块考试化学试卷(解析版) 题型:计算题
某双原子分子构成的气体,其摩尔质量为M g/mol,该气体质量为m g,阿伏加德罗常数为NA,则:
(1)该气体在标准状况下的体积为__________L;
(2)该气体在标准状况下的密度为________g/L;
(3)该气体所含原子总数为__________个;
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省大连市高二上学期期末考试(理)化学试卷(解析版) 题型:实验题
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。下表是4种常见指示剂的变色范围:
指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
(1)反应生成的CH3COONa显_________f性,用离子方程式解释原因:____________,则实验中应选用上表中的__________作指示剂。
(2)用标准的NaOH溶液滴定待测的白醋时,如何判断滴定终点:_________________。
(3)第一次滴定前后,碱式滴定管中的液面位置如右图所示,请将有关数据填入下面表格的空白处。
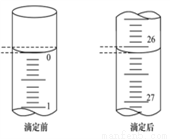
滴定次数 | 待食用白醋的体积/mL | 0.1000 mol/L NaOH溶液的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | ______ | _______ | ________ |
第二次 | 25.00 | 1.56 | 28.08 | 26.52 |
第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
(4)从上表可以看出,第二次实验中记录消耗NaOH溶液的体积明显多于其余两次,其原因可能是________。
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
C.第二次滴定用的锥形瓶用待装液润洗过
D.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(5)根据所给数据,计算该白醋中醋酸的物质的量浓度:c=______________。
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三3月高考适应性测试理综化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W的原子序数依次增大.它们的原子最外层电子数之和为13 , X的原子半径比Y的小,其中X与W同主族。一种常见的无色无味液体分解可以得到X和Z元素的单质。下列说法中不正确的是
A. X、Y、Z三种元素可以形成离于化合物
B. 元素X 和W之间不可能形成二元化合物
C. 元素Y的简单气态氢化物的热稳定性比Z的弱
D. 元素Y、Z、W中,元素W的简单离子的半径最小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com