
| A. | 已知2C(s)+2O2(g)═2CO2(g)△H1 2C(s)+O2(g)═2CO(g)△H2 则△H1>△H2 | |
| B. | 一定条件下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3放热19.3 kJ,热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 已知OH-(aq)+H+(aq)═H2O(l)△H=-57.3 kJ/mol 则稀硫酸溶液与稀氢氧化钡溶液反应的反应热△H=2×(-57.3)kJ/mol | |
| D. | 相同条件下,2 mol氢原子所具有的能量大于1 mol氢分子所具有的能量 |
分析 A.燃烧反应为放热反应,完全燃烧放出热量多;
B.合成氨为放热反应,热化学方程式中为完全转化时的能量变化;
C.生成1mol水放热57.3kJ,生成硫酸钡放热;
D.形成化学键释放能量.
解答 解:A.燃烧反应为放热反应,完全燃烧放出热量多,则2C(s)+2O2(g)═2CO2放出热量多,可知△H1<△H2,故A错误;
B.合成氨为放热反应,热化学方程式中为完全转化时的能量变化,由0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3放热19.3 kJ,可知热化学方程式为N2(g)+3H2(g)?2NH3(g)△H<-38.6 kJ•mol-1,故B错误;
C.生成1mol水放热57.3kJ,生成硫酸钡放热,由OH-(aq)+H+(aq)═H2O(l)△H=-57.3 kJ/mol 可知稀硫酸溶液与稀氢氧化钡溶液反应的反应热△H<2×(-57.3)kJ/mol,故C错误;
D.形成化学键释放能量,则相同条件下,2 mol氢原子所具有的能量大于1 mol氢分子所具有的能量,故D正确;
故选D.
点评 本题考查热化学方程式,为高频考点,把握反应中能量变化、燃烧热和中和热为解答的关键,侧重分析与应用能力的考查,注意选项C为易错点,题目难度不大.


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
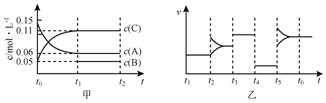
| A. | 若t1=15s,生成物C在t0~t1时间段的平均反应速率为0.004mol•L-1•s-1 | |
| B. | t4~t5阶段改变的条件为降低反应温度 | |
| C. | B的起始物质的量为0.02mol | |
| D. | t5~t6阶段容器内A的物质的量减少0.03mol,而此过程中容器与外界的热交换总量为akJ,该反应的热化学方程式为3A(g)?B(g)+2C(g)△H=-100akJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | ①③ | C. | ②④⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 至少5个原子同在一条直线上 | B. | 所有的原子在一个平面上 | ||
| C. | 4个碳原子同在一条直线上 | D. | 4个氢原子不在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌粒与稀硫酸的反应 | B. | 灼热的木炭与CO2反应 | ||
| C. | 甲烷在氧气中的燃烧反应 | D. | 钠与水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 分别向2.0mL 0.1mol/LCH3COOH溶液和2.0mL 0.1mol/LH3BO3溶液中滴加等浓度的NaHCO3溶液,前者有气泡产生,后者无明显现象 | 酸性:CH3COOH>H2CO3>H3BO3 |
| B | 在酒精灯上分别加热打磨和未打磨的铝箔,现象都是铝箔熔化不滴落 | 铝能被氧气氧化成氧化铝 且熔点:氧化铝>铝 |
| C | 加热盛有浓硫酸和可抽动铜丝的试管,并将产生的气体通入到品红溶液中,观察到品红溶液褪色,试管中产生蓝色溶液 | 浓硫酸具有强氧化性 |
| D | 向漂白粉中加入较浓的盐酸,并将湿润的淀粉碘化钾试纸置于试管口,观察到产生气泡,试纸未变蓝 | 漂白粉已经失效 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机玻璃受热软化,易于加工成形,是一种硅酸盐材料 | |
| B. | 常用的灭火器成分有干冰、四氯化碳等 | |
| C. | 生活中常见的金属镁、铝均能通过热还原法冶炼 | |
| D. | 河水中有许多杂质和有害细菌,加入明矾消毒杀菌后可以饮用 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 为除去粗盐中的CaCl2、MgCl2、Na2SO4以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
为除去粗盐中的CaCl2、MgCl2、Na2SO4以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com