
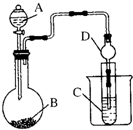
| A. | 仪器A的名称长颈漏斗,仪器 D的名称为球形干燥管 | |
| B. | 若利用上装置验证非金属性:Cl>S,装置A、B、C中所装药品应分别为稀盐酸、MnO2、Na2S溶液 | |
| C. | 若利用上装置证明非金属性:S>C>Si,装置A、B、C中所装药品应分别为稀硫酸、Na2CO3溶液、Na2SiO3溶液,观察到B中产生气泡,试管C中出现白色沉淀现象,则可以证明非金属性:S>C>Si | |
| D. | 装置A、B、C中所装药品应分别为稀盐酸、Na2CO3溶液、Na2SiO3溶液,观察到B中产生气泡,试管C中出现白色沉淀现象,则可以证明非金属性:Cl>C>Si |
分析 A.A仪器中带有活塞,是分液漏斗;
B.单质的氧化性越强,其元素的非金属性越强;
C.证明非金属性:S>C>Si,利用强酸制取弱酸的反应原理;
D.最高价氧化物的水化物的酸性越强,其元素的非金属性越强.
解答 解:A.A仪器中带有活塞,是分液漏斗,仪器 D的名称为球形干燥管,故A错误;
B.单质的氧化性越强,其元素的非金属性越强,氯气与Na2S溶液反应生成S,所以要制备氯气,稀盐酸与二氧化锰不反应,应该用浓盐酸与二氧化锰加热,故B错误;
C.明非金属性:S>C>Si,利用强酸制取弱酸的反应原理,则B中硫酸与碳酸钠反应产生气泡,试管C中发生二氧化碳与硅酸钠的反应,出现有白色胶状沉淀产生,故C正确;
D.最高价氧化物的水化物的酸性越强,其元素的非金属性越强,HCl不是最高价氧化物的水化物,故D错误.
故选C.
点评 本题考查探究非金属的比较,为高频考点,把握非金属性强弱的比较方法及实验装置的作用为解答的关键,明确除杂试剂、装置及原则,侧重分析与实验能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 它的最外层电子数为4 | B. | 它的金属性比铅强 | ||
| C. | 它的最高价氧化物的水化物是强酸 | D. | 它的位置在第7周期IVA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解水生成氢气和氧气时,电能转化为化学能 | |
| B. | 白炽灯工作时,电能全部转化为光能 | |
| C. | 煤燃烧时,化学能主要转化为热能 | |
| D. | 绿色植物的光合作用时,将光能转变为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-己烯能使KMnO4(H+)溶液褪色 | |
| B. | 汽油、煤油、柴油和植物油都是碳氢化合物 | |
| C. | 乙烯、苯都可与溴水发生加成反应 | |
| D. | 乙烯和聚乙烯都能发生加聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸的电子式  | |
| B. | S2-的结构示意图: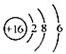 | |
| C. | 质子数为92,中子数为143的铀原子:23592U | |
| D. | NH4I的电子式: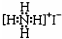 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
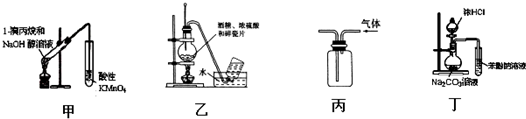
| A. | 用甲装置检验1-溴丙烷消去产物 | |
| B. | 实验室用乙装置制取乙烯 | |
| C. | 用丙装置收集甲烷气体 | |
| D. | 用丁装置证明酸性强弱:盐酸>碳酸>苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | X、Y元素的金属性 X<Y | |
| B. | W的氢化物比同族其它元素的氢化物稳定,是因为W的氢化物中存在氢键 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 一定条件下,W单质可以将Z单质从其氢化物中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com