
A、B、C、D、E是五种短周期元素,原子序数依次增大。前四种的原子序数之和是E的原子序数的二倍。E的阳离子与D的阴离子都比A阳离子多2个电子层。D与四种元素中任意一种都可形成原子个数比不相同的若干种化合物。B是形成化合物种类最多的元素。请回答下列问题:
(1)写出元素符号:A________,E________。
(2)D在周期表中位于第_______周期第________族。
(3)五种元素原子半径由大到小的顺序是(用A~E字母表示)_______________。
(4)A、B、C、D可形成一种受热易分解的化合物,写出该化合物受热分解的化学方程式____________________________________________________________。
(5)A、B、D可形成A2B2D4型化合物,该化合物的名称是_____________。
(1)H,Na
(2)2,VI A
(3)E > B > C > D > A
(4)NH4HCO3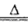 NH3↑+H2O+CO2↑
NH3↑+H2O+CO2↑
(5)乙二酸(草酸)
解析试题分析:(1)B是形成化合物种类最多的元素,B是C元素;D与四种元素中任意一种都可形成原子个数比不相同的若干种化合物,猜测D是O元素,则A是H元素,C是N元素,H、C、N、O的原子序数和是E的原子序数的2倍,则E是Na元素。符合Na的阳离子与O的阴离子都比H阳离子多2个电子层,说明推断正确。
(2)O在周期表中位于第2周期,第VIA;
(3)根据元素周期律中原子半径的变化规律,五种元素原子半径由大到小的顺序是E>B>C>D>A;
(4)A、B、C、D可形成一种受热易分解的化合物,该化合物是碳酸氢铵,化学方程式为NH4HCO3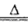 NH3↑+H2O+CO2↑;
NH3↑+H2O+CO2↑;
(5)分子式为C2H2O4的化合物是乙二酸。
考点:考查元素推断,元素位置的判断,原子半径的比较,化学方程式的书写,物质名称的判断


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
写出10电子微粒
①原子__ ___② 分子___________________________
③ 阴离子______________________④ 阳离子_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(14分)A、B、C、D、E、F是原子序数依次增大的六种短周期元素。F的单质在D2中燃烧的产物可使品红溶液褪色;B的单质在D2中燃烧可生成BD和BD2两种气体;E的原子序数为B的两倍;A元素的一种核素中不含中子。请回答下列问题:
(1)C的单质分子的结构式为 ;ED的电子式为 。
(2)E单质在BD2中剧烈燃烧生成黑白两种固体,该反应的化学方程式为 。
(3)FD2气体通入BaCl2和HNO3的混合溶液中,生成白色沉淀和无色气体CD,有关反应的离子方程式为 ,由此可知CD和FD2中还原性较强的是 (填化学式)。
(4)A、C、D、F四种元素按原子个数比为5 :1 :4 :1形成化合物甲,则甲的化学式为 。将0.01mol/L的甲溶液与0.03mol/L的Ba(OH)2溶液等体积混合得到沉淀,已知该沉淀的Ksp="x" ,则混合溶液中酸根离子的浓度为 mol / L(用含x的代数式表示,混合后溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期主族元素。常温下A、B、C的常见单质均为无色、无味的气体,D、E的单质均为固体。C与E同主族,且E的原子序数为C的2倍,D的最外层电子数比最内层多1个,F是人体血红蛋白中含有的一种金属元素,请回答下列问题:
(1)D元素在周期表中的位置是 周期 族。
(2)A与C形成的18电子分子的结构式为 。
(3)最近意大利罗马大学的Funvio Cacace等人获得了极具理论研究意义的B4分子。B4分子结构如右图所示,已知断裂l molB-B吸收167kJ热量,生成1 mo1B2放出942kJ热量。根据以上信息和数据,下列说法正确的是 。
A.B4比P4(白磷)既含有极性键又含有非极性键
B.l molB4气体转变为B2吸收882kJ热量
C.B4与B2互为同素异形体
D.B4与B2分子中各原子最外电子层均达到8电子稳定结构
(4)写出过量的F与稀硝酸反应的离子方程式
(5)以D为阳极,在H2SO4溶液中电解,D表面形成氧化膜,阳极电极反应式为 。
(6)在常温,常压和光照条件下,B2在催化剂(TiO2)表面与A2C反应,生成1molBA3(g)和C2时的能量变化值为382.5kJ,此反应BA3生成量与温度的实验数据如下表。则该反应的热化学方程式为 。
| T/K | 303 | 313 | 323 |
| BA3生成量/(10-1mol) | 4.3 | 5.9 | 6.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某同学做元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系)。
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
| ②向新制得的Na2S溶液中滴加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体 |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀 |
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A~F) | | | | | | |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法中正确的是( )
| A.分子中键能越大,键长越长,则分子越稳定 |
| B.sp3杂化轨道是由同一个原子中能量相近的s 轨道和p轨道混合起来形成的一组能量相近的新轨道 |
| C.PCl5分子中P原子和Cl原子最外层都满足8电子结构 |
| D.用价层电子互斥理论预测H2S和BF3的立体结构,分别为V形和平面正三角形 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.熔化干冰和熔化NaCl晶体所克服的作用力相同 |
| B.氢键比分子间作用力强,所以它属于化学键 |
| C.H2O是一种非常稳定的化合物,这是由于氢键所致 |
| D.冰的密度比水小,这是由于冰中存在氢键所致 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com