
某同学对MnO2、CuO、Fe2O3、Cr2O3在氯酸钾受热分解反应中的催化作用进行了研究。实验所得数据如下表。就本实验的有关问题,请填空:
| 实验编号 | KClO3(g) | 氧化物 | 产生气体(mL)(已折算为标况) | 耗时(s) | ||
| 化学式 | 质量(g) | 实际回收 | ||||
| 1 | 0.6 | — | — | — | 10 | 480 |
| 2 | 0.6 | MnO2 | 0.20 | 90% | 67.2 | 36.5 |
| 3 | 0.6 | CuO | 0.20 | 90% | 67.2 | 79.5 |
| 4 | 0.6 | Fe2O3 | 0.20 | 90% | 67.2 | 34.7 |
| 5 | 0.6 | Cr2O3 | 0.20 | 异常 | 67.2 | 188.3 |
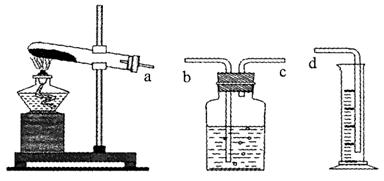
(1)a→c→b→d(2分)
(2)过滤→洗涤→干燥→称量(2分)
(3)2KClO3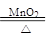 2KCl+3O2↑(3分)
2KCl+3O2↑(3分)
(4)Fe2O3、MnO2、CuO(3分)
(5)Cl2(2分);润湿的淀粉碘化钾(2分);氯酸钾与Cr2O3发生氧化还原反应,生成氯气。(2分)
解析试题分析:(1)根据排水法测气体体积的进气方式为:短管进气长管出水,所用连接顺序为a→c→b→d。
(2)MnO2难溶于水,测定反应剩余物MnO2的质量,要溶解、过滤、洗涤、干燥、称量。
(3)编号2为MnO2作催化剂,氯酸钾分解制取氧气,化学方程式为:2KClO3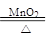 2KCl+3O2↑
2KCl+3O2↑
(4)根据生成相同体积氧气时所用时间的长短,Fe2O3作催化剂用时最短,MnO2作催化剂用时次之,CuO作催化剂用时最长,所以其催化能力从大到小的顺序为:Fe2O3 >MnO2 >CuO。
(5)用Cr2O3做研究实验时,发现有刺激性气味的气体产生,同时绿色的混合物变成了橘黄色,则Cr元素的化合价升高,Cl元素的化合价降低,氯酸钾在加热条件下将Cr2O3氧化为可溶性化合物,同时生成氯气,其化学式为Cl2,氯气能使湿润的淀粉碘化钾试纸变蓝,则可以使用湿润的淀粉碘化钾试纸检验氯气。
考点:本题考查化学反应速率影响的因素、探究催化剂对化学反应速率的影响及催化效果、化学反应现象的分析与判断。


科目:高中化学 来源: 题型:计算题
(4分)在一固定容积的密闭容器中,a mol/LN2和b mol/L H2反应,一定条件下经过2min达到平衡,生成c mol/L NH3.
求:(1)用H2表示的速率是多少?(2)N2的转化率是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
2012年2月27日深圳宣称进入“200万辆汽车时代”,汽车尾气已成为重要的空气污染物。
(1)汽车内燃机工作时引起反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向2L密闭容器中充入4mol N2和6molO2,5min后达平衡时NO物质的量为4mol,该反应的速率v(N 2)为 ;计算该条件下的平衡常数(写出计算过程)。
2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向2L密闭容器中充入4mol N2和6molO2,5min后达平衡时NO物质的量为4mol,该反应的速率v(N 2)为 ;计算该条件下的平衡常数(写出计算过程)。
(2)恒温恒容,能说明反应 2NO(g)  N2(g)+O2(g) 达到平衡的是 (填代号)。
N2(g)+O2(g) 达到平衡的是 (填代号)。
| A.NO、N2、O2的浓度之比为2∶1∶1 |
| B.N2的浓度不再发生变化 |
| C.单位时间内消耗2 mol NO,同时消耗1 mol N2 |
| D.容器内气体密度不再发生变化 |
 2CO2(g)+ N2(g) 中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,据此判断该反应的△H 0 (填“>”、“<”或“无法确定”)。若催化剂的表面积S1>S2 ,在下图中画出NO的浓度在T1、S2条件下达到平衡过程中的变化曲线,并注明条件。
2CO2(g)+ N2(g) 中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,据此判断该反应的△H 0 (填“>”、“<”或“无法确定”)。若催化剂的表面积S1>S2 ,在下图中画出NO的浓度在T1、S2条件下达到平衡过程中的变化曲线,并注明条件。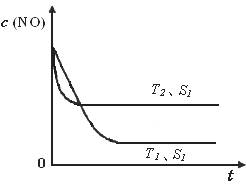
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
碘在科研与生活中有重要应用。某兴趣小组用0.50mol·L-1KI、0.2%淀粉溶液、0.20mol·L-1K2S2O8、0.10mol·L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O82-+2I-═2SO42-+I2(慢),I2+2S2O32-═S4O62-+2I- (快),
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的Na2S2O3耗尽后,溶液颜色将由无色变成为 色。为确保能观察到该现象,S2O32—与S2O82—初始的物质的量需满足的范围为:n(S2O32—):n(S2O82—) 。
(2)为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表: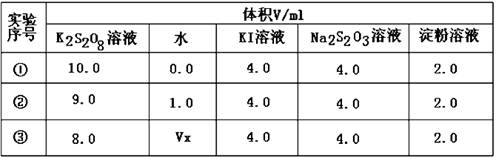
表中Vx= mL,反应速率最快的是 (填序号)。
(3)已知图中A曲线为某条件下,浓度c(S2O82—)~ 反应时间t的变化曲线图,若保持
其他条件不变, (填“B”或“C”)曲线为降低反应温度, (填“B”或“C”)曲线为加入催化剂。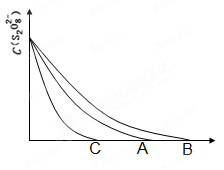
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图1、2所示的实验。请回答相关问题。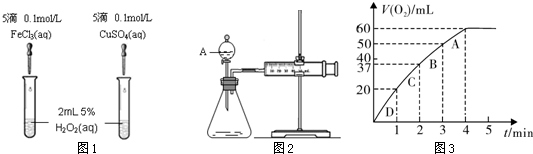
(1)定性分析:如图1可通过观察 ,定性比较得出结论。有同学提出将FeCl3改为0.05 mol/L Fe2(SO4)3更为合理,其理由是 。
(2)定量分析:如图2所示,实验时均生成40 mL气体,其它可能影响实验的因素均已忽略。实验中需要测量的数据是 。
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图3所示。
①写出H2O2在二氧化锰作用下发生反应的化学方程式 。
②实验时放出气体的总体积是 mL。
③A、B、C、D各点反应速率快慢的顺序为: > > > 。
解释反应速率变化的原因 。
④H2O2的初始物质的量浓度是 (请保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟制备氨基甲酸铵,并探究其分解反应平衡常数。反应的化学方程式: 2NH3(g)+CO2(g) NH2COONH4(s)。请按要求回答下列问题:
NH2COONH4(s)。请按要求回答下列问题:
(1)请在下图1方框内画出用浓氨水与生石灰制取氨气的装置简图。
(2)制备氨基甲酸铵的装置如下图2所示。生成的氨基甲酸铵小晶体悬浮在四氯化碳中。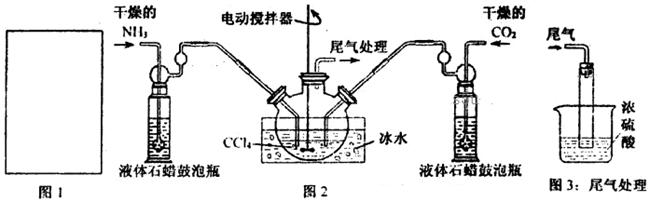
①从反应后的混合物中分离出产品的实验方法是_____________(填操作名称)。
②上图3中浓硫酸的作用是_______________________________________。
(3)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积
忽略不计),在恒定温度下使其达到分解平衡。实验测得不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
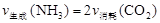
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
(一)制取氧化铜
①称取2 gCuSO4·5H2O研细后倒入烧杯,加10 mL蒸馏水溶解;
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀,然后将所得混合物加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤,晾干后研细备用。
回答下列问题:
(1)上述实验步骤中需要使用玻璃棒的是_______________(填实验序号),步骤②中加热所用仪器的名称是___________________;
(2)步骤③中洗涤沉淀的操作是___________________________________。
(二)证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较
用下图装置进行实验,实验时均以生成25 mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表: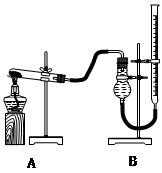
| 实验序号 | KClO3质量 | 其它物质质量 | 待测数据 |
| ④ | 1.2 g | 无其他物质 | |
| ⑤ | 1.2 g | CuO 0.5 g | |
| ⑥ | 1.2 g | MnO2 0.5 g | |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在25℃的条件下,下列叙述正确的是
A.将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO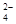 )= c(NH4+) )= c(NH4+) |
| B.pH=3的醋酸溶液,稀释至原体积的10倍后pH=4 |
| C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,溶液pH<7 |
| D.向0.1mol·L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-) 增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com