
(15分)(1)A、B、C、D、E、F六种物质在一定条件下有如图所示的转化关系,所有反应物和生成物均已给出。
①若反应①②③均为水溶液中的置换反应,A、D、E都为卤素单质,化合物中的阳离了均为Na+,则A、D、E的氧化性由弱到强的顺序为 (写化学式)。在一定条件下E和D以物质的量比为5:l在硫酸溶液中恰好完全反应,写出该反应的离子方程式: 。
②若把B、C、F三种溶液汇集在一起得到1L混合溶液,并物质的转化关系给其中加入一定量的E,溶液中卤素阴离子的物质的量与通入E的体积(标准状况)的关系如下表所示(x和y均大于0)。
各离子的量与E的体积的关系
I.当通入E的体积为2.8L时,溶液中发生反应的离子方程式为 。
II.x= ,y= (填具体数据)。
III.当通入E的体积为11.2L时,该溶液中c(Na+)=____ mol·L-1(通入E后溶液的体积变化忽略不计)。
(2)用H2O2可除去工业尾气中的Cl2,相关反应:
H2O2(1)+Cl2(g) 2HCl(g)+O2(g)△H>0.
2HCl(g)+O2(g)△H>0.
①为了提高H2O2的除氯效果,采取的措施最好的是 (只改变一种条件),其原因是: 。
(g)+ O2(g)= H2O(1), △H2 = -285.84kJ·mol-l
O2(g)= H2O(1), △H2 = -285.84kJ·mol-l
Cl2(g)+ H2(g)= 2HCl(g), △H3 = -184.6kJ·mol-l
则H2O2(1)与Cl2(g)反应生成HCl(g)和O2(g)的热化学方程式为 。

解析试题分析:⑴①若反应①②③均为水溶液中的置换反应,A、D、E都为卤素单质,则A为Br2,D为I2,E为Cl2,三者的氧化性由弱到强的顺序为I2<Br2<Cl2;在一定条件下E(Cl2)和D(I2)以物质的量比为5:l在硫酸溶液中恰好完全反应,据得失电子守恒有5Cl2+I2――10Cl-+2IO3-,再据电荷守恒有5Cl2+I2――10Cl-+2IO3-+12H+,最后据原子守恒得5Cl2+I2+6H2O=10Cl-+2IO3-+12H+。
②由于B为NaI、C为NaBr、F为NaCl,E为Cl2,据表中的数据说明当E(Cl2)通入2.8L→5.6L时依次发生的离子反应为:
Cl2 + 2I- = 2Cl- + I2 Cl2 + 2Br-  2Cl- + Br2
2Cl- + Br2
0.15mol 1.5-1.25-0.1=0.15mol 0.1mol 0.1mol
则x=0.15mol,y=1.4-(2-1.5)=0.9mol;
当通入E的体积为11.2L时,据电荷守恒得该溶液中c(Na+)=2+0.9=2.9mol·L-1。
⑵①根据反应原理(吸热反应),升高温度,反应速率增大,平衡向右移,提高H2O2的除氯效果(减压虽能使平衡向右移动,但会导致反应速率慢,故不是最好措施);
②据题意先写出反应方程式并标出各物质的状态H2O2(l)+ Cl2(g)=2HCl(g)+ O2(g),依次將三条热化学方程式编号为①②③,将“①×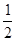 -②+③”得该反应方程式,据盖斯定律得该反应的反应热△H=(-196.46)×
-②+③”得该反应方程式,据盖斯定律得该反应的反应热△H=(-196.46)×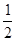 -(-285.84)+(-184.6)=+3.01kJ·mol-l,据此便可写出完整的热化学方程式。
-(-285.84)+(-184.6)=+3.01kJ·mol-l,据此便可写出完整的热化学方程式。
考点:考查元素及其化合物知识、化学计算、盖斯定律的应用等


 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:单选题
 下列说法中不正确的是
下列说法中不正确的是
A.高吸水性树脂属于功能高分子材料
B.SiC、Al2O3的熔点很高,可用作高温结构陶瓷
C.光导纤维、合成纤维和人造纤维都是有机高分子化合物
D.合金拓展了金属材料的使用范围,合金中也可能含有非金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。
请回答下列问题:
(1)写出下列物质的化学式:B_________、丙_________、乙_________。
(2)写出下列反应的离子方程式:
反应①_____________________________________________;
反应⑤_____________________________________________;
反应⑥_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z原子与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:1。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,它们的分子式分别是_____、_______;杂化轨道分别是________、_________;a分子的立体结构是____________;
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是_______晶体、_______晶体;
(3)X的氧化物与Y的氢化物中,分子极性较小的是(填分子式) ;
(4)Y与Z比较,电负性较大的是____________;
(5)W的元素符号是 ,其+2价离子的核外电子排布式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
有五种原子序数在36以内的元素A、B、C、D、E,它们的原子序数依次增大,A原子的最外层电子数等于其电子层数,A、B、C原子核外电子层数之和是6,C原子的电子数为A和B两元素原子电子总数的两倍;D和C的最高价氧化物对应水化物的酸性前者强于后者;E可和C形成原子个数比为1:1和1:2的两种化合物,其中一种物质是工业合成硫酸的常见原料,这两种化合物的摩尔质量相差32。试回答下列问题:
(1)E在周期表中的位置是 ,基态B原子的价电子排布式 。
(2)写出CD2的电子式 ,根据价层电子对互斥(VSEPR)理论推测,CD2分子的空间构型为 ,该分子是 分子(填“极性”或“非极性”)。
(3)通常情况下,AB3为无色有刺激性气味的液体,沸点303.8K,熔点193K。AB3固态时的晶体类型为 ;其水溶液有弱酸性,它的电离方程式为 。
(4)下列性质可作为比较C、D两元素非金属性强弱依据的是 (填编号)。
①C、D的最高价氧化物对应水化物的酸性强弱
②C、D的气态氢化物的水溶液的酸性强弱
③C、D的气态氢化物的稳定性强弱
④C、D的简单离子是否易被E3+氧化
⑤相同条件下,C、D的钠盐溶液的碱性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
【化学——选修5:有机化学基础】(15分)
化合物H可用以下路线合成: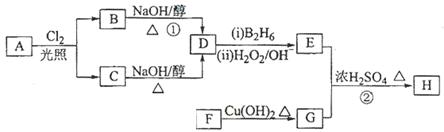
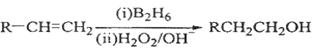
已知:
请回答下列问题:
(1)标准状况下11.2 L烃A在氧气中充分燃烧可以生成88 g CO2和45 g H2O,且A分子结构中有3个甲基,则A的结构简式为 ;
(2)B和C均为一氯代烃,D的名称(系统命名)为 ;
(3)在催化剂存在下1 mol F与2 mol H2反应,生成3—苯基—1—丙醇。F的结构简式是 ;
(4)反应①的反应类型是 ;
(5)反应②的化学方程式为 ;
(6)写出所有与G具有相同官能团的芳香类同分异构体的结构简式
。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
乙炔是一种重要的基本有机原料,在一定条件下其衍变关系如下图:
已知,B是一种塑料,75%的D溶液在医药上用作消毒剂。试回答下列问题:
49. 比乙炔多一个碳原子的同系物的结构简式是 。
50. A物质的结构简式是 。
51. 写出C→D反应的化学方程式 。
52. A→B反应类型是 。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(12分)【化学——有机化学基础】
某有机化合物K的合成路线如下:‘
已知:
III.E的核磁共振氢谱图中只有一个吸收峰。
请回答下列问题:
(1)A的分子式为_______,C→D的反应类型为_______。
(2)鉴别E、G所用的试剂除NaOH溶液外,还需要的试剂有_______(填试剂名称)。
(3)符合下列条件的C的同分异构体共有_______种。
①能与溴水发生加成反应②能使氯化铁溶液显紫色
③苯环上有三个取代基且能发生银镜反应
(4)J在一定条件下可以发生聚合反应得到一种高聚物,该高聚物的结构简式为____ ____________________。
(5)D+J→K的化学方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(15分)化合物F(匹伐他汀)用于高胆固醇血症的治疗,其合成路线如下:
(1)化合物D中官能团的名称为 、 和酯基。
(2)A→B的反应类型是 。
(3)写出同时满足下列条件的A的一种同分异构体的结构简式
I.分子中含有两个苯环;Ⅱ.分子中有3种不同化学环境的氢;Ⅲ.不含一O—O一。
(4)实现D→E的转化中,化合物X的分子式为C19H15NFBr,写出其结构简式: 。
(5)已知:化合物E在CF3COOH催化作用下先转化为 ,再转化为F。你认为合成路线中设计步骤②的目的是 。
,再转化为F。你认为合成路线中设计步骤②的目的是 。
(6)上述合成路线中,步骤③的产物除D外还生成 ,该反应原理在有机合成中具有广泛应用。试写出以
,该反应原理在有机合成中具有广泛应用。试写出以 为主要原料制备
为主要原料制备 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
CH3CH2OH CH2=CH2
CH2=CH2 CH3CH3
CH3CH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com