

| 物质 | H2(g) | CO2(g) | CH2=CH2(g) | H2O(g) |
| 能量/kJ•mol-1 | 0 | -394 | 52 | -242 |
分析 (1)在700K条件下,CO2和FeO发生反应生成C和Fe3O4,过程1中Fe3O4分解生成FeO和O2,所以整个反应过程中FeO作催化剂,根据反应物和生成物及反应条件书写方程式;
(2)焓变等于生成物总能量减去反应物总能量;
(3)①相同条件下,投料比[X=$\frac{n({H}_{2})}{n(C{O}_{2})}$]越大,二氧化碳的转化率越大,据此判断X1、X2的相对大小;该反应的正反应是放热反应,温度越高其平衡常数越小;
②若B点的投料比为3,且从反应开始到B点需要10min,n(CO2)=2mol,则n(H2)=10mol,B点二氧化碳的转化率为75%,则参加反应的n(CO2)=2mol×75%=1.5mol,根据二氧化碳和氢气之间的关系式知,参加反应的n(H2)=3n(CO2)=4.5mol,则v(H2)=$\frac{\frac{△n}{V}}{△t}$;
(4)①根据图知,生成氧气的电极是阳极,则连接阳极的电源电极为正极;
②阴极上二氧化碳得电子和氢离子反应生成丙烯和水.
解答 解:(1)在700K条件下,CO2和FeO发生反应生成C和Fe3O4,过程1中Fe3O4分解生成FeO和O2,所以整个反应过程中FeO作催化剂,根据反应物和生成物及反应条件书写方程式为CO2$\frac{\underline{\;△或太阳能\;}}{FeO}$C+O2,
故答案为:CO2$\frac{\underline{\;△或太阳能\;}}{FeO}$C+O2;
(2)焓变等于生成物总能量减去反应物总能量,则该反应的焓变=[52+(-242)×4-(-392)×2-0]kJ/mol=-128kJ/mol,故答案为:-128kJ/mol;
(3)①相同条件下,投料比[X=$\frac{n({H}_{2})}{n(C{O}_{2})}$]越大,二氧化碳的转化率越大,根据图知,相同温度下X1的转化率大于X2,所以X1>X2;该反应的正反应是放热反应,温度越高其平衡常数越小,温度A<B,所以平衡常数A>B,
故答案为:>;>;
②若B点的投料比为3,且从反应开始到B点需要10min,n(CO2)=2mol,则n(H2)=10mol,B点二氧化碳的转化率为75%,则参加反应的n(CO2)=2mol×75%=1.5mol,根据二氧化碳和氢气之间的关系式知,参加反应的n(H2)=3n(CO2)=4.5mol,则v(H2)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{4.5mol}{2L}}{10min}$=0.225mol/(L.min),
故答案为:0.225mol/(L.min);
(4)①根据图知,生成氧气的电极是阳极,则连接阳极的电源电极为正极,所以b为正极,
故答案为:正极;
②阴极上二氧化碳得电子和氢离子反应生成丙烯和水,电极反应式为3CO2+18H++18e-=CH3CH=CH2+6H2O,故答案为:3CO2+18H++18e-=CH3CH=CH2+6H2O.
点评 本题考查化学平衡计算、原电池和电解池原理等知识点,为高频考点,侧重考查学生分析计算能力,难点是电极反应式的书写,注意结合电解质溶液酸碱性书写.


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | B. | 水分子的比例模型: | ||
| C. | 硅的原子结构示意图: | D. | Na2S的电子式 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
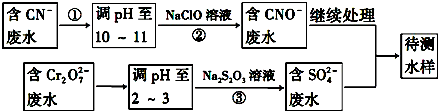
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
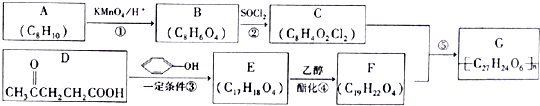
 →
→ +HCl
+HCl ;
;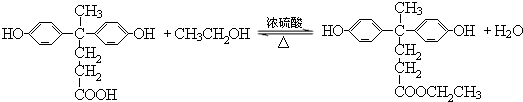 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
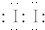 (用电子式表示).
(用电子式表示).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
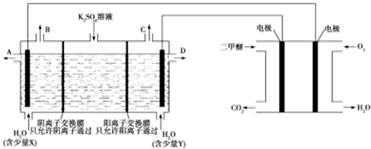
| A. | Y为KOH | |
| B. | A口导出的物质为H2SO4 | |
| C. | 二甲醚燃料电池的负极反应式为CH3OCH3+3H2O-12e-═2CO2+12H+ | |
| D. | 若燃料电池通入CH3OCH3(g)的速率为0.1mol/min,2min时,理论上C口收集到气体的体积为26.88L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com