
| A. | 二氧化硫可广泛用于食品的漂白 | |
| B. | 酸雨是指pH<7.0的雨水 | |
| C. | 蛋白质和葡萄糖等高分子化合物是人体必需的营养物质 | |
| D. | 明矾可用作净水剂 |
分析 A.二氧化硫有毒;
B.酸雨的pH<5.6;
C.葡萄糖的相对分子质量在10000以下,不是高分子;
D.根据盐类水解的生成物的性质分析;
解答 解:A.二氧化硫有毒,不能用于食品漂白,故A 错误;
B.酸雨的pH<5.6,酸雨中溶解了二氧化硫,酸性增强,故B错误;
C.葡萄糖的相对分子质量在10000以下,不是高分子,而蛋白质为高分子,葡萄糖和蛋白质均是人体必需的营养物质,故C错误;
D.明矾是强酸弱碱盐,在水溶液里能发生水解生成氢氧化铝胶体,氢氧化铝胶体具有吸附性,所以能作净水剂,故D正确;
故选:D.
点评 本题通过考查物质在生活中的应用,熟悉高分子化合物、酸雨概念,明确明矾净水原理是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 活性炭/mol | NO/mol | A/mol | B/mol | P/MPa | |
| 200℃ | 2.000 | 0.0400 | 0.0300 | 0.0300 | 3.93 |
| 335℃ | 2.005 | 0.0500 | 0.0250 | 0.250 | P |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加水,S${O}_{3}^{2-}$浓度增大 | |
| B. | 通入少量Cl2气体,溶液pH增大 | |
| C. | 加少量CaSO3粉末,HS${O}_{3}^{-}$ 浓度基本不变 | |
| D. | 通入少量HCl气体,溶液中HS${O}_{3}^{-}$ 浓度减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
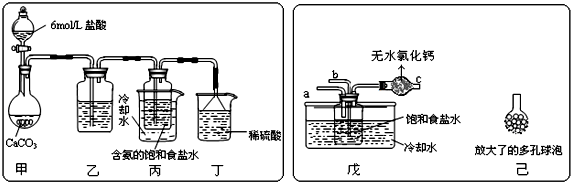
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
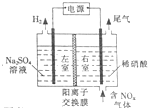 电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益.实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极).
电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益.实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
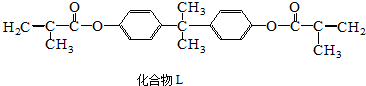
| A. | 1mol L分别与足量NaOH溶液和H2反应,最多可消耗4molNaOH和10molH2 | |
| B. | 有机酸M与油酸互为同系物,双酚A与苯酚互为同系物 | |
| C. | 与M含相同官能团的同分异构体还有2种 | |
| D. | 等物质的量的L、A和M 与足量浓溴水发生反应,消耗Br2的量之比为1:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S的水溶液中滴加新制氯水后出现浑浊 | |
| B. | Cl原子最外层有7个电子,而S原子最外层有6个电子 | |
| C. | HCl水溶液的酸性强于H2S水溶液的酸性 | |
| D. | HClO4的酸性比H2SO3的酸性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然气、酒精和汽油分别属于化石能源、可再生能源和二次能源 | |
| B. | 富含N、P元素的生活用水可以直接用来灌溉农田 | |
| C. | 液晶态介于晶体状态和液态之间,液晶具有一定程度的晶体的有序性和液体的流动性 | |
| D. | 我国油品从国 IV 汽油升级到国 V 汽油,有助于减少酸雨、雾霾,提高空气质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com