
| A. | 1 mol TX2与足量X2反应生成TX3的分子数目为NA | |
| B. | Z元素形成的可溶性盐溶液可能显碱性 | |
| C. | 1 mol Y2X2与足量H2O反应转移的电子数目为2NA | |
| D. | 0.1 molQ元素的含氧酸在水中电离出的H十数目为3NA |
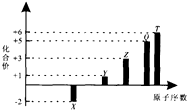
分析 由图中化合价可知,X的化合价为-2价,没有正化合价,故X为O元素,Y的化合价为+1价,处于ⅠA族,原子序数大于O元素,故Y为Na元素,Z为+3价,为Al元素,Q的化合价为+5价,故Q为P元素,T的最高正价为+6价,应为S元素,结合对应单质、化合物的性质以及题目要求解答该题.
解答 解:由图中化合价可知,X的化合价为-2价,没有正化合价,故X为O元素,Y的化合价为+1价,处于ⅠA族,原子序数大于O元素,故Y为Na元素,Z为+3价,为Al元素,Q的化合价为+5价,故Q为P元素,T的最高正价为+6价,应为S元素,
A.1molSO2与O2反应为可逆反应,1molSO2与足量O2反应生成SO3的分子数目小于NA,故A错误;
B.Al元素形成的可溶性盐如NaAlO2在溶液中显碱性,故B正确;
C.Na2O2与H2O的反应2Na2O2+2H2O=4NaOH+O2↑,反应中2molNa2O2转移2mol电子,则1mol Na2O2与足量H2O反应转移的电子数目为NA,故C错误;
D.P的含氧酸H3PO4为中强酸,在溶液中部分电离,所以0.1molP元素的含氧酸在水中电离出的H+数目为小于0.3NA,故D错误.
故选B.
点评 本题考查结构性质与位置关系、元素周期律等,难度不大,根据推断元素是解题的关键,根据化合价结合原子序数进行推断,侧重于考查学生的分析能力和对基础知识的应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 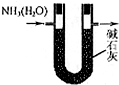 用如图装置干燥氨气 | |
| B. | 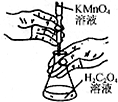 用如图装置进行高锰酸钾溶液滴定草酸溶液实验 | |
| C. | 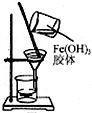 用如图装置可分离氢氧化铁胶体中Fe(OH)3和水 | |
| D. |  用如图装置可验证酸性:盐酸>碳酸>苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是一种锂钒氧化物热电池装置,电池总反应为xLi+LiV3O8=Li1+xV3O8.工作时,需先引发铁和氯酸钾反应使共晶盐融化.已知:Li熔点181℃,LiCl-KCl共晶盐熔点352℃.下列说法正确的是( )
如图是一种锂钒氧化物热电池装置,电池总反应为xLi+LiV3O8=Li1+xV3O8.工作时,需先引发铁和氯酸钾反应使共晶盐融化.已知:Li熔点181℃,LiCl-KCl共晶盐熔点352℃.下列说法正确的是( )| A. | 整个过程的能量转化只涉及化学能转化为电能 | |
| B. | 放电时正极反应为:Li1+xV3O8-xe?═LiV3O8+xLi+ | |
| C. | 放电时Cl?移向LiV3O8电极 | |
| D. | Li-Si合金熔点高于352℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢化物的沸点:c>d | |
| B. | a、b、d的最高价氧化物对应的水化物两两皆能反应 | |
| C. | a、b、c的简单离子都会破坏水的电离平衡 | |
| D. | 简单离子的半径:c>d>a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Y的气态氢化物的沸点在同主族中最高,所以其气态氢化物最稳定 | |
| B. | W的氧化物与X、Z形成的化合物中所含化学键相同 | |
| C. | 简单离子半径:W>Z>Y | |
| D. | 单质的氧化性:Y>W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子的半径:W>Z>Y>X | |
| B. | W和M形成的化合物是离子化合物 | |
| C. | 五种元素中只有X存在同素异形体 | |
| D. | 工业上采用电解W和Z形成的化合物制备W单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com