
| A、金属钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
| B、Ag2S沉淀溶解平衡表达式:Ag2S?2Ag++S2- |
| C、氢硫酸与硫酸铜反应:S2-+Cu2+=CuS↓ |
| D、NaHCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O |


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
 在一个烧杯中盛有100mL2 mol/L的H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央(如图).向烧杯里缓缓地注入0.4mol/L的Ba(OH)2溶液至恰好完全反应,对此实验回答下列问题.
在一个烧杯中盛有100mL2 mol/L的H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央(如图).向烧杯里缓缓地注入0.4mol/L的Ba(OH)2溶液至恰好完全反应,对此实验回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,3gCO和25gN2组成的混合气体中所含原子总数为2NA |
| B、标准状况下11.2L CCl4中所含共价键数目为2NA |
| C、在100mL 1mol/L的Na2CO3溶液中,含有的CO32-数目为0.1NA |
| D、2molSO2、1molO2充分反应后,转移电子数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢钠的电离方程式:NaHCO3═Na++H++CO32- |
| B、碳酸钙的沉淀溶解平衡表达式:CaCO3(s)?Ca2+(aq)+CO32-(aq) |
| C、氯化铝发生水解的离子方程式:Al3++3H2O═Al(OH)3+3H+ |
| D、亚硫酸的电离方程式:H2SO3?2H++SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
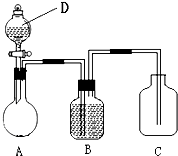 为确认C6H5OH、H2CO3、CH3COOH的酸性强弱,某同学设计了如图所示装置,一次实验即可达到目的(不必选用其他酸性物质).请据此实验回答下列问题:
为确认C6H5OH、H2CO3、CH3COOH的酸性强弱,某同学设计了如图所示装置,一次实验即可达到目的(不必选用其他酸性物质).请据此实验回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com