
| A、水溶性:NH3>H2S>I2 |
| B、沸点:HF>HCl>HBr |
| C、硬度:金刚石>晶体硅>碳化硅 |
| D、熔点:LiF>KF>NaF |


科目:高中化学 来源: 题型:
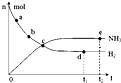 科学家一直致力于“人工固氮”的新方法研究.目前合成氨技术原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ?mol-1.在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
科学家一直致力于“人工固氮”的新方法研究.目前合成氨技术原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ?mol-1.在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A、点a的正反应速率比点b的大 |
| B、点c处反应达到化学平衡状态 |
| C、点d和点e处的n(N2)不相同 |
| D、点e反应达到化学平衡状态,反应停止 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、丙烷 | B、乙醇 | C、乙酸 | D、丙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解水制取氢气是理想且经济的制氢方法 |
| B、利用化石燃料燃烧放热使水分解是理想的制氢方法 |
| C、氢燃料电池汽车的使用可以有效减少城市空气污染 |
| D、发展氢燃料电池汽车不需要安全、高效的储氢技术 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水的离子积就是水的电离平衡常数 |
| B、若强酸、强碱中和后溶液的pH=7,则中和之前酸、碱的pH之和一定等于14 |
| C、Ksp反映了物质在水中的溶解能力,可直接根据Ksp的数值大小比较电解质在水中溶解度大小 |
| D、盐溶液的酸碱性主要决定于形成盐的酸和碱的相对强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 常温下,15ml某待测物质的量浓度的盐酸,用一定物质的量浓度的NaOH溶液滴定的滴定曲线如图所示,则两种溶液的物质量的浓度分别是( )
常温下,15ml某待测物质的量浓度的盐酸,用一定物质的量浓度的NaOH溶液滴定的滴定曲线如图所示,则两种溶液的物质量的浓度分别是( )| A | B | C | D | |
| c(HCl)(mol/L) | 0.12 | 0.06 | 0.05 | 0.1 |
| c(NaOH)(mol/L) | 0.06 | 0.12 | 0.1 | 0.05 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、家用铁锅残留盐溶液时易发生吸氧腐蚀 |
| B、电解水制氢气时,用铜作阳极 |
| C、电解法精炼粗铜,用纯铜作阴极 |
| D、在镀件上电镀锌,用锌作阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图甲表示向乙酸溶液中通入NH3过程中溶液导电性的变化 |
| B、由图乙可知若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO至pH在4左右 |
| C、图丙表示25°C时,用0.1mol/L盐酸滴定20mL 0.1mol.L-1氨水,溶液的pH随加入盐酸体积的变化 |
| D、图丁表示向Al2(SO4)3溶液中滴入NaOH溶液,生成Al(OH)3沉淀的量随NaOH溶液体积的变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com