
分析 (1)溶液中氢离子浓度等于氢氧根离子浓度时,溶液呈中性,注意不能根据溶液pH值大小确定溶液的酸碱性;水的电离是吸热反应,升高温度能促进水的电离;
(2)混合液为中性,则氢氧化钠与氯化氢的物质的量相等,据此计算a:b;
(3)①如果酸是强电解质,一元酸的浓度与氢离子浓度相等,二元酸的浓度为氢离子浓度的一半;如果酸是弱电解质,一元酸的浓度大于氢离子浓度;
②c(H+)相同、体积相同时,生成氢气体积大小与最终氢离子的物质的量成正比;
③醋酸是弱电解质,稀释过程中能够促进醋酸的电离,盐酸和硫酸属于强电解质,溶液中完全电离据此比较稀释后c(H+)由大到小.
解答 解:(1)溶液中氢离子与氢氧根离子物质的量相等,则该溶液为中性;
常温下中性溶液pH=7,c(H+)=c(OH-)=10-7mol/L,水的电离为吸热过程,升高温度促进水的电离,溶液c(H+)增大,pH=6,c(H+)=c(OH-)=10-6mol/L,此时温度高于常温,
故答案为:中;高于;
(2)将25℃下pH=12的NaOH溶液的浓度为0.01mol/L,pH=1的HCl溶液的浓度为0.1mol/L,若所得混合液为中性,则氢氧化钠和氯化氢的物质的量相等,即:0.01mol/L×aL=0.1mol/L×bL,整理可得:a:b=10:1,
故答案为:10:1;
(3)①相同浓度时电离产生的氢离子浓度越大,所需的物质的量浓度最小,所以物质的量浓度最小的是H2SO4(硫酸),最大的是醋酸,
故答案为:c>a>b;
②当c(H+)相同、体积相同时,盐酸、硫酸完全电离,只有醋酸在继续电离,则分别加入足量锌,相同状况产生的气体体积由大到小的顺序为c>a=b,
故答案为:c>a=b;
③醋酸在稀释过程中,会促进电离,所以氢离子的物质的量增加,氢离子的浓度变化程度小,硫酸和盐酸溶液中氢离子物质的量不变且相等,所以c(H+)由大到小的顺序是c>a=b,
故答案为:c>a=b.
点评 本题考查了弱电解质的电离平衡及其影响,题目难度中等,明确弱电解质电离特点是解本题关键,注意掌握水的离子积及其影响因素,试题知识点较多、综合性较强,充分考查学生的分析能力及灵活应用基础知识的能力.


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
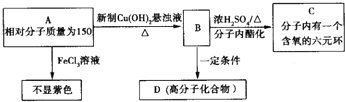
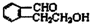 ;
;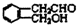 .
. ;此A对应的B生成C的反应:
;此A对应的B生成C的反应: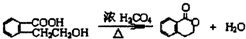 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由紫色变为无色 | B. | 颜色无明显变化 | C. | 先褪色,后复原 | D. | 由紫色变为红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
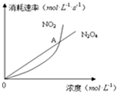 在80℃时,将0.40mol 的N2O4气体充入2L 已经抽成真空的固定容积的密闭容器中,发生如下反应:N2O4(g)?2NO2(g)△H=+56.9kJ/mol,隔一段时间对该容器内的物质进行分析,得到如下数据:
在80℃时,将0.40mol 的N2O4气体充入2L 已经抽成真空的固定容积的密闭容器中,发生如下反应:N2O4(g)?2NO2(g)△H=+56.9kJ/mol,隔一段时间对该容器内的物质进行分析,得到如下数据:| 时间/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
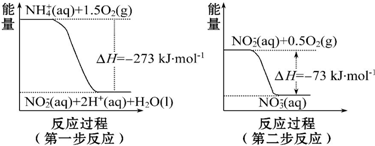
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解饱和氯化钠溶液:2Cl-+2H+ $\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ | |
| B. | 用银氨溶液检验乙醛中的醛基: CH3CHO+2Ag(NH3)2++2OH-$\stackrel{水浴加热}{→}$CH3COONH4+3NH3+2Ag↓+H2O | |
| C. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2+ 3H2O | |
| D. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
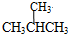 和
和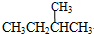 ;⑦
;⑦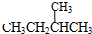 和
和
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com