
【题目】碳、氮及其化合物在工农业生产生活中有着重要作用,请回答下列问题:
(1)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2
若2 molCH4还原NO2至N2,整个过程中放出的热量为1734 kJ,则△H2=_________;
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁,其反应如下:Fe2O3(s)+3CH4(g)===2Fe(s)+3CO(g)+6H2(g) △H>0
① 若反应在5 L的密闭容器中进行,1 min后达到平衡,测得Fe2O3在反应中质量减少3.2g。则该段时间内CO的平均反应速率为__________mol/(L·s)
② 若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是__________(选填序号)
A.CH4的转化率等于CO的产率
B.混合气体的平均相对分子质量不变
c.v(CO)与v(H2)的比值不变
D.固体的总质量不变
③该反应达到平衡时某物理量随温度变化如图所示,当温度由T1升高到T2时,平衡常数KA________KB(填“>”、“<”或“=”),纵坐标表示的物理量可能是__________(填字母)。
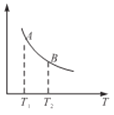
A.H2的逆反应速率
B.CH4的的体枳分数
C.混合气体的平均相对分子质量
D.CO的体积分数
(3)而一些科学家采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为N2+3H2![]() 2NH3,该过程中还原反应的方程式为________________。
2NH3,该过程中还原反应的方程式为________________。
(4)若往20 mL0.01mol/L的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如下图所示,下列有关说法正确的是_____________(填标号)
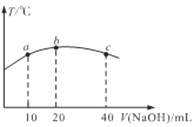
①该烧碱溶液的浓度为0.02mol/L
②该烧碱溶液的浓度为0.01mol/L
③HNO2的电离平衡常数:b点>a点
④从b点到c点,混合溶液中一直存在:c(Na+)> c(NO2-) >c(OH-)> c(H+)
【答案】(1)-1160kJ/mol;
(2)①2×10-4或0.0002;②bd;③<;bc;
(3)N2+6H++6e-=2NH3;(4)②③。
【解析】
试题分析:(1)①CH4(g)+4NO2(g)=4NO(g) + CO2(g) + 2H2O(g) ,②CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-1734/2kJ·mol-1=-867kJ·mol-1,②×2-①得出△H2=(-867×2+574)kJ·mol-1=-1160kJ·mol-1;(2)①生成CO的物质的量为3.2×3/160mol=0.06mol,根据化学反应速率的表达式v(CO)=0.06/(5×60)mol/(L·s)=0.0002mol/(L·s);②a、CH4的转化率等于CO的产率,不能说明反应达到平衡,故错误;b、反应前气体的摩尔质量为16g·mol-1,假设反应彻底反应到底,气体的平均摩尔质量为(3×28+6×2)/9g·mol-1=10.7g·mol-1,气体摩尔质量减小,当气体平均摩尔质量不再改变,说明反应达到平衡,故正确;c、化学反应速率之比等于化学计量数之比,不能说明反应达到平衡,故错误;d、根据化学平衡状态的定义,组分的浓度不再改变说明反应达到平衡,即CO的体积分数不变,说明反应达到平衡,故正确;③此反应正反应是吸热反应,生成温度,平衡正向移动,B点温度高于A,因此KA<KB,a、升高温度,正逆反应速率都增大,故错误;b、升高温度,平衡正向移动,甲烷量减小,体积分数降低,故正确;c、根据上述分析,向正反应方向进行,气体的平均摩尔质量减少,故正确;d、反应向正反应方向进行,CO的体积分数增大,故错误;(3)还原反应是化合价降低,得到电子,因此N2被还原,因此电极反应式为N2+6H++6e-=2NH3;(4)b点温度最高,说明b点两者恰好完全反应,因此NaOH的浓度为0.01mol·L-1,故选项②正确;弱电解质的电离是吸热过程,升高温度,促进电离,即b点电离平衡常数大于a点,故选项③正确;④c点溶质为NaNO2和NaOH,且两者物质的量相等,NO2-是弱酸根,要发生水解,c(OH-)>c(NO2-),故错误。


科目:高中化学 来源: 题型:
【题目】镍电池开始应用于新能源汽车,但电池使用后电极材料对环境还是有一定的危害, 某型号镍电池的电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。研究小组设计如下工艺流程,对该电池的电极材料进行资源回收:

已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②实验温度时的溶解度:NiC2O4> NiC2O4H2O> NiC2O42H2O
③某温度下:Ksp[Ni(OH)2] = 5.0×10-16、Ksp[NiC2O4]=4.0×10-10、Ksp[Fe(OH)3]=4.0×10-38、Ksp[Al(OH)3]=3.0×10-34
回答下列问题:
(1)用NiO调节溶液的pH,首先析出的沉淀是__________,控制这两种沉淀能够依次析出可利用________(仪器名称)。
(2)过滤①得到的沉淀为___________,洗涤Ni(OH)3沉淀的方法是__________。
(3)写出加入NaOH溶液发生反应的离子方程式_________,该反应的化学平衡常数K=_________。
(4)电解过程中阴极反应式为___________,沉淀Ⅲ可被电解所得产物之一氧化,写出“氧化”的离子方程式____________。
(5)铁镍蓄电池的电池总反应为Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,该电池的电解液为___________(填“酸性”或“碱性”)溶液,充电时正极的电极反应式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种物质间的相互转化关系如图所示
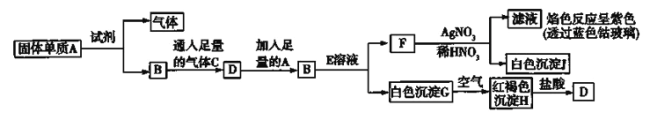
请回答
(1)A转化为B及气体的反应中应加入的试剂是(填化学式) 。
(2)写出B的化学式: ,F的化学式: 。
(3)写出G转化为H的化学方程式: 。
(4)写出检验D溶液中金属阳离子的方法: (用离子方程式表示);向D溶液中加入A,发生反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】施用碳酸氢铵、氯化铵等铵态氮肥能够促进农作物生长,但是铵态氮肥不能与碱性肥料如草木灰混合使用,其原因是铵态氮肥( )
A.易溶于水
B.能与碱反应
C.受热易分解
D.在水中易发生电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于蛋白质的下列说法正确的是 ( )
A.蛋白质在体内代谢的最终产物是硝酸
B.灼烧蛋白质没有明显现象
C.误食重金属盐会使人中毒,应立即喝牛奶、豆浆解毒
D.加热会使蛋白质变性,因此生吃鸡蛋比熟吃好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是进行化学研究的重要环节,下列有关化学实验的说法正确的是( )
A. 向滴有KSCN的FeCl3溶液中加入NaOH溶液以研究反应物浓度对化学平衡的影响
B. 用酒精萃取碘水中的碘,水从分液漏斗下口放出,碘的酒精溶液从分液漏斗上口倒出
C. 将高锰酸钾溶液装入碱式滴定管中进行滴定实验,以测定某FeSO4样品的纯度
D. 为制备硅酸胶体,以酚酞为指示剂,将浓盐酸滴入饱和Na2SiO3溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300mLAl2(SO4)3溶液中含Al3+1.62g,在该溶液中加入0.1 mol/LBa(OH)2溶液300mL,反应后溶液中SO42-的物质的量浓度为(混合体积看成是两溶液体积之和)( )
A.0.4mol/L B.0.3 mol/L C.0.2 mol/L D.0.1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲是CO2电催化还原为碳氢化合物(CxHy)的工作原理示意图,用某钾盐水溶液做电解液;图乙 是用H2还原CO2制备甲醇的工作原理示意图,用硫酸为电解质溶液。下列说法中不正确的是( )
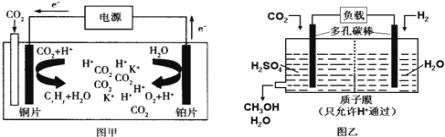
A.甲中铜片作阴极,K+向铜片电极移动
B.甲中若CxHy为C2H4,则生成1mol C2H4的同时生成3mol O2
C.乙中H2SO4的作用是增强溶液的导电性
D.乙中正极发生的电极反应为CO2+5e-+6H+═CH3OH+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com