
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
分析 ①中为了不引入其他杂质离子,应加氨水使Fe3+沉淀,而不能用氢氧化钠溶液;
②中根据溶解度表可知Mg(OH)2易转化为Fe(OH)3,因此在氯化镁溶液中加入足量的Mg(OH)2可除去Fe3+;
③由于Fe(OH)2的溶解度大于Fe(OH)3,所以一般将Fe2+先氧化成Fe3+,再调节溶液的pH=4,形成Fe(OH)3沉淀;
(1)Fe(OH)2的溶解度大于Fe(OH)3,上述三个除杂方案都能够达到很好的效果,Fe2+、Fe3+都被转化为Fe(OH)3而除去;
(2)除去铁离子,可加入氨水,防止引入其它杂质;
(3)除去氯化镁晶体中的杂质Fe3+,加入氢氧化镁,可消耗酸,调节溶液pH,促进水解;
(4)A.根据H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染;
B.根据将Fe(OH)2的溶解度大于Fe(OH)3,沉淀不完全;
C.在pH>4的溶液中Fe3+全部以Fe(OH)3完全沉淀;
D.加入氢氧化铜或碱式碳酸铜可以与H+反应.H+反应后,pH增大,当pH=4的时候,Fe(OH)3完全沉淀,而Cu2+还没沉淀,以Cu2+形式存在,而氢氧化铜或碱式碳酸铜是固体,不会引入新的杂质.
解答 解:①中为了不引入其他杂质离子,应加氨水使Fe3+沉淀,而不能用氢氧化钠溶液;
②中根据溶解度表可知Mg(OH)2易转化为Fe(OH)3,因此在氯化镁溶液中加入足量的Mg(OH)2可除去Fe3+;
③由于Fe(OH)2的溶解度大于Fe(OH)3,所以一般将Fe2+先氧化成Fe3+,再调节溶液的pH=4,形成Fe(OH)3沉淀;
(1)由以上分析可知Fe3+、Fe2+ 都被转化为氢氧化铁沉淀,
故答案为:氢氧化铁;
(2)①中为了不引入其他杂质离子,应加氨水使Fe3+沉淀,而不能用氢氧化钠溶液,
故答案为:氨水;不会引入新的杂质;
(3)②中根据溶解度表可知Mg(OH)2易转化为Fe(OH)3,发生Fe3+:2Fe3+(aq)+3Mg(OH)2(s)═3Mg2+(aq)+2Fe(OH)3(s),
故答案为:2Fe3+(aq)+3Mg(OH)2(s)═3Mg2+(aq)+2Fe(OH)3(s);
(4)A.H2O2是绿色氧化剂,还原产物为水,在氧化过程中不引进杂质、不产生污染,故A正确;
B.Fe(OH)2的溶解度大于Fe(OH)3,将Fe2+氧化为Fe3+的主要原因是防止沉淀不完全,故B错误;
C.由表中数据可知Fe(OH)3的溶解度为3×10-9g,则饱和溶液的c(OH-)=3c(Fe(OH)3)=$\frac{\frac{3×1{0}^{-9}g}{107g/mol}}{0.1L}$=3.0×10-10mol/L,则在pH>4的溶液中Fe3+全部以Fe(OH)3完全沉淀,Fe3+一定不能大量存在,故C正确;
D.由表中数据可知Cu(OH)2的溶解度为1.7×10-6g,则饱和溶液的c(OH-)=2c(Cu(OH)2)=$\frac{\frac{1.7×1{0}^{-6}g}{98g/mol}}{0.1L}$≈3.4×10-7mol/L>1×10-10mol/L,所以Cu2+可以大量存在于pH=4的溶液中,故D正确;
故答案为:ACD.
点评 本题以难溶电解质的溶解平衡为载体综合考查物质的分离、提纯,为高频考点,侧重学生的分析、实验能力的考查,注意把握盐类水解的原理以及溶解平衡的理解和运用,难度中等.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | NH4Cl的电子式: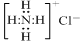 | |
| B. | 2-硝基甲苯的结构简式: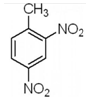 | |
| C. | 硫原子结构示意图: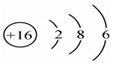 | |
| D. | 质子数为94、中子数为144的钚原子:${\;}_{94}^{144}$Pu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④⑤ | B. | ①② | C. | ①②③⑤ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg | B. | Mg | C. | $\frac{M}{6.02×1{0}^{23}}$g | D. | Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳是形成物种最多的元素之一,许多含碳物质对人类极其重要.
碳是形成物种最多的元素之一,许多含碳物质对人类极其重要.| 时间/min | 0 | 10 | 20 | 30 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锅炉水垢中的CaSO4经饱和碳酸钠溶液浸泡可转化为CaCO3 | |
| B. | 常温下,在含有Ag+和Cl-的溶液中,Ag+和Cl-浓度之积是个常数 | |
| C. | 当醋酸达到电离平衡后,改变某条件电离平衡向正反应方向移动,则溶液的导电能力一定变强 | |
| D. | 将浓度为0.1 mol/L的HF溶液加水不断稀释,溶液$\frac{c({F}^{-})}{c({H}^{+})}$始终保持增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下,向含有AgCl固体的饱和溶液,加少量水稀释,c(Ag+)和Ksp(AgCl)均保持不变 | |
| B. | pH=5的CH3COOH与CH3COONa的混合溶液中:c(Na+)>c(CH3COO-) | |
| C. | 将0.2mol/LCH3COOH溶液和0.1mol/LNaOH溶液等体积混合,则反应后的混合溶液中:2c(OH-)+c(CH3COO-)=2c(H+)+c(CH3COOH) | |
| D. | 将水加热煮沸,能促进水的电离,Kw增大,pH增大,溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ag C2H4和C3H6的混合物所含原子总数为$\frac{a{N}_{A}}{14}$ | |
| B. | 0.5mol/L MgCl2溶液,含有Cl-离子数为NA | |
| C. | 10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8% | |
| D. | 300 mL 2 mol/L蔗糖溶液中所含分子数大于0.6NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com