
 +<Rb+<Cs+ B.密度:Li<Na<K<Rb<Cs
+<Rb+<Cs+ B.密度:Li<Na<K<Rb<Cs .原子半径:
.原子半径: Li<Na<K<Rb<Cs
Li<Na<K<Rb<Cs 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源:不详 题型:填空题
 ,E的最高价氧化物的水化物难溶于水,已知298K时,该难溶物质的的KSP=5.6×10-12,若此时测得溶液pH
,E的最高价氧化物的水化物难溶于水,已知298K时,该难溶物质的的KSP=5.6×10-12,若此时测得溶液pH查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 ;
; 件下制取常见果实催熟剂的化学方程式:
件下制取常见果实催熟剂的化学方程式: :
: (C6Li表示锂原子嵌入石墨形成的复合材料,LiMO2表示含锂的过渡金属氧化物)回答:
(C6Li表示锂原子嵌入石墨形成的复合材料,LiMO2表示含锂的过渡金属氧化物)回答: -xe-=C6Li1-x+xLi+,则正极反应为: ;⑵电池放电时若转移1mol e-,消
-xe-=C6Li1-x+xLi+,则正极反应为: ;⑵电池放电时若转移1mol e-,消 耗的负极材料 g。
耗的负极材料 g。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.单质与氢气化合的难易程度:M难于N |
| B.最高价氧化物对应水化物的酸性: M弱于N |
| C.简单阴离子的还原性:M强于N |
| D.M的单质能从含N的简单阴离子的溶液中置换出N单质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 键的具体类型(即参与成键的原子轨道)
键的具体类型(即参与成键的原子轨道) 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.形成离子键的阴阳离子间只存在静电吸引吸引力 |
| B.第三周期元素的最高正化合价等于它所处的主族序数 |
| C.短周期元素形成离子后,最外层都达到8电子稳定结构 |
| D.同一元素不可能既表现金属性,又表现非金属性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
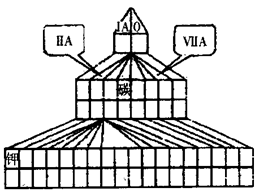
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com