
(1)���룬�������Ӻ���ȡ�����õ������ϣ����ᷢ��ʲô�仯��
(2)��֪ÿ���������ֹ�����ͷų�164 m3�ļ������壬�Լ������ֹ�����ˮ���������ʵ���֮�ȣ���ù�����ܶȦ�=1 g��cm-3������������ѻ���Ϊ��״������
(3)�����밲ȫ�����ؿ�������ȼ�����Ŀ����Է�����
������(1)���ڡ���ȼ����(�ɱ�ʾΪCH4��nH2O)���ں�ˮ�ĸ�ѹ�������γɵı������壬����֮�Ӻ���ȡ�����õ����³�ѹ�ĵ����ϣ�����Ȼ��ֽ��CH4��H2O��CH4����ɢ�������У�����������һϵ�еĻ������⣨�硰����ЧӦ������
![]()
�ۺ�Ϊm(CH4)=7321 mol��16 g��mol-1=1.17��105g
1 m3��ȼ��������Ϊ��
m(��ȼ��)=1 m3��106 cm3��m-3��1 g��cm-3=1��106 g
����ˮ������Ϊ��
m(H2O)=1��106 g-1.17��105g=8.83��105g
![]()
�ʸÿ�ȼ���У�n(H2O)��n(CH4)=4.91��104 mol��7321 mol=6.7��1
�𰸣���1�����е�CH4����ɢ�������� ��2��6.7��1 ��3���ٽ�����������뵽����ȼ�������У���ѹʹ����ӿ������������ȫ���գ���ʹ��˫�Ŀ�����ܣ�����ڲ�һ��Ϊ��������������롰��ȼ�����������ˮ��������ܵ�һ��ѹ�롰�����㣬�Ӷ�ʹ����ȼ����������������ܵ���һ���ռ������ļ������壻��������ѧ��������ȫ�Ŀ��ɷ�����


 ������ӱ������ͯ������ϵ�д�
������ӱ������ͯ������ϵ�д� A�ӽ��� ϵ�д�
A�ӽ��� ϵ�д� ȫ�Ų��Ծ�ϵ�д�
ȫ�Ų��Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ʱ��/min | CO | H2O��g�� | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | C1 |
| 6 | 0.096 | 0.266 | 0.104 | C2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��CH4 | B��C2H4 | C��C2H2 | D��C02 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������������ ���ͣ�038
����ȼ����������ں�������Դ�����������ļ���ˮ����ҹ��Ϻ������м���ḻ�ġ���ȼ������Դ��
(1)���룬�����Ӻ���ȡ���õ������ϣ��ᷢ��ʲô�仯��
(2)��֪ÿ���������ֹ����ͷ�164 �ļ������壬�Լ������ֹ�����ˮ���������ʵ���֮��(��ù�����ܶ�Ϊ
�ļ������壬�Լ������ֹ�����ˮ���������ʵ���֮��(��ù�����ܶ�Ϊ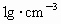 ������������ѻ���Ϊ��״��)��
������������ѻ���Ϊ��״��)��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com