
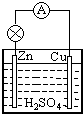
 原电池是直接把化学能转化为电能的装置.如图所示:
原电池是直接把化学能转化为电能的装置.如图所示:分析 ①原电池中活泼金属做负极;负极上活泼金属失电子发生氧化反应;正极上溶液中的阳离子得电子;
②原电池中电子从负极流向正极;原电池中阴离子移向原电池的负极.
解答 解:①在Cu-Zn原电池中,活泼金属Zn做负极;负极上Zn失电子发生氧化反应生成锌离子,其电极反应为:Zn-2e-=Zn2+;正极上溶液中的铜离子得电子生成Cu,其电极反应式为:2H++2e-=2H2↑;
故答案为:氧化;Zn-2e-=Zn2+;正; 2H++2e-=2H2↑;
②原电池中电子从负极流向正极,所以外电路中,电子流向正极;原电池中阴离子移向原电池的负极,则内电路溶液中,SO42-移向负极;
故答案为:正;负.
点评 本题考查了原电池原理,负极发生氧化反应,正极发生还原反应,电流由正极流向负极,题目难度中等.


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 固体碘与NH4Cl的混合物可以用加热升华的方法分离 | |
| B. | 过滤时,慢慢地将液体直接倒入过滤器中 | |
| C. | 可以用米汤检验含碘食盐中的碘元素 | |
| D. | 水银洒落时,可在其表面覆盖一层硫粉进行处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| Fe3+ | Cu2+ | Fe2+ | |
| 开始沉淀的pH | 2.7 | 5.4 | 8.1 |
| 沉淀完全的pH | 3.7 | 6.9 | 9.6 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡金属元素与非金属元素之间都形成离子键 | |
| B. | 形成离子键的微粒必须是金属阳离子与阴离子 | |
| C. | 含有离子键的化合物中,也可能还含有共价键 | |
| D. | 非金属元素形成的化合物一定不存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④⑥ | C. | ①②⑥ | D. | ①⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3- | |
| B. | [H+]=10-12 mol•L-1的溶液:K+、Ba2+、Cl-、Br- | |
| C. | [OH-]/[H+]=1012的溶液中:NH4+、Al3+、NO3-、CO32- | |
| D. | 由水电离的[H+]=1.0×10-13 mol•L-1的溶液中:K+、NH4+、[Al(OH)4]-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4H是共价化合物 | B. | NH4H溶于水,所形成的溶液显碱性 | ||
| C. | NH4H与水反应时,水作还原剂 | D. | NH4H中的H元素只有一种化合价 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸钙溶液中通入过量二氧化碳 Ca2++2C1O+H2O+CO2=CaCO3↓+2HClO | |
| B. | 硫酸亚铁溶液中加入过氧化氢溶液 Fe2++2H2O2+4H+=Fe3++4H2O | |
| C. | 用氨水吸收少量二氧化硫 NH3•H2O+SO2=NH4++HSO3- | |
| D. | 硝酸铁溶液中加入过量氨水 Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com