
| A. | 8.12天津爆炸事件后,为处理现场散落的剧毒物NaCN,应喷洒双氧水 | |
| B. | 明矾和高铁酸盐都可用于饮用水的处理,因为它们均能杀菌消毒 | |
| C. | 向煤中加入适量石灰石,使煤燃烧产生的SO2最终生成CaSO3,可减少对大气的污染 | |
| D. | 氢氧化铝、碳酸钠都是常见的胃酸中和剂 |
分析 A、氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出氮气;
B、明矾溶液中水解生成氢氧化铝胶体具有吸附悬浮杂质的作用,可以净水,但不能消毒;
C、石灰石与煤燃烧时产生的SO2及空气中的O2反应;
D、碳酸钠的碱性强不用于胃酸中和剂.
解答 解:A、氰化钠溶液的CN-被双氧水氧化为HCO3-,剧毒的氰化钠(NaCN) 喷洒双氧水处理利用的是双氧水的氧化性将氰化钠氧化为无毒物质,故A正确;
B、明矾溶于水生成氢氧化铝胶体,具有吸附色素和杂质的性能,通常用作净水剂,但不能用于杀菌消毒,故B错误;
C、向煤中加入适量石灰石.石灰石与煤燃烧时产生的SO2及空气中的O2反应,生成CaSO4和CO2,而不是亚硫钙,故C错误;
D、碳酸钠的碱性强不用于胃酸中和剂,而氢氧化铝、碳酸氢钠都是常见的胃酸中和剂,故D错误;
故选A.
点评 本题考查知识面较广,涉及明矾净水、环境保护、胃酸中和剂等知识,题目难度不大,A为易错点.


科目:高中化学 来源: 题型:实验题

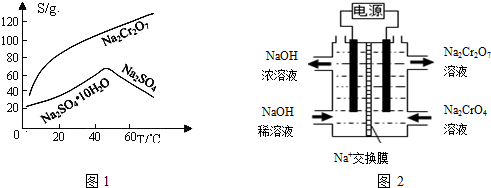
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 )
) .由甲苯生成甲的反应类型是取代反应.
.由甲苯生成甲的反应类型是取代反应. +HOCH2CH2Cl$→_{△}^{浓硫酸}$
+HOCH2CH2Cl$→_{△}^{浓硫酸}$ +H2O.
+H2O. .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30%的双氧水分解生成氧气的速率小于5%的双氧水 | |
| B. | 5℃时的双氧水分解生成氧气的速率小于50℃时的双氧水 | |
| C. | 加入MnO2后的双氧水分解生成氧气的速率小于未加MnO2时的双氧水 | |
| D. | 加入FeCl3后的双氧水分解生成氧气的速率小于未加FeCl3时的双氧水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 遇到苯酚显紫色的溶液:SCN-、Na+、SO32-、Cl- | |
| B. | 含有Na2CO3的溶液:Al3+、Ca2+、Cl-、NO3- | |
| C. | 通入足量CO2的溶液:K+、SiO32-、Cl-、NO3- | |
| D. | 25℃时pH<7的溶液:K+、Cu2+、Fe3+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | M点时,Y的转化率最大 | |
| B. | 升高温度,平衡常数减小 | |
| C. | 平衡后充入Z,达到新平衡时Z的体积分数增大 | |
| D. | W、M两点Y的正反应速率相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com