
 CO2和CH4都是要削减的温室气体.
CO2和CH4都是要削减的温室气体.| 反应时间 | 0 | 5 | 10 | 12 |
| CH4/mol?L-1 | 8.0 | 6.5 | 5.5 | 4.0 |
| CO2/mol?L-1 | 6.0 | 4.5 | 3.5 | 2.0 |
| △c |
| △t |
| △c |
| △t |
| 6.0mol/L-4.5mol/L |
| 5s |
| c2(H)?c2(CO) |
| c(CO2)?c(CH4) |
| 8.02×8.02 |
| 2.0×4.0 |


科目:高中化学 来源: 题型:
| A、I2、Br、Cl2、F2 |
| B、F2、Cl2、Br2、I2 |
| C、F-、Cl-、Br-、I- |
| D、Li、Na、K、Rb |
查看答案和解析>>
科目:高中化学 来源: 题型:
 江西某铜业公司在火法炼铜时也生产硫酸,硫酸车间如图.下列叙述不正确的是( )
江西某铜业公司在火法炼铜时也生产硫酸,硫酸车间如图.下列叙述不正确的是( )| A、自然界化合态硫以FeS、CuFeS2等形式存在 |
| B、火法炼铜的矿石原料主要含Cu2S |
| C、该公司炼铜产生的SO2可用于生产H2SO4 |
| D、l mol/L H2SO4溶液可储存于铁制或铝制容器 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、起始原料是①② |
| B、起始原料是②⑥ |
| C、最终产品是④⑤ |
| D、最终产品是③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| CH3COOH | H2CO3 | H2S |
| 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 错误原因 | |
| 改正方法 | |
| 对实验结果的影响 |
| 质量 | 实验前 | 实验后 |
| 药品+U形管的质量/g | 101.1 | 102.9 |
| 药品+广口瓶D的质量/g | 312.0 | 314.2 |
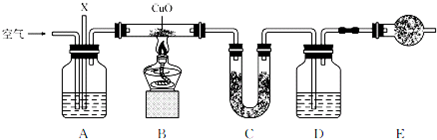
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可以用灼烧线头的方法鉴别纺织物是毛织物还是棉织物 |
| B、除去SO3中混有的少量SO2,可将混合气体通过盛有热浓硫酸的洗气瓶 |
| C、室温下向苯和少量苯酚的混合液中加入适量Na2CO3溶液,振荡、静置后分液,可除去苯中少量苯酚 |
| D、已知I3-?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,不能说明KI3在CCl4中的溶解度比在水中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能发生加成反应的有机物一定含有碳碳双键或碳碳叁键或碳氧双键 |
| B、二氯乙烷、三氯乙烷、四氯乙烷均只有两种同分异构体 |
| C、乙烯、聚氯乙烯和苯分子中均含有碳碳双键 |
| D、糖类、油脂和蛋白质均可发生水解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com