
| A.X是第ⅠA元素,Z是第ⅦA元素 | B.X、Y、Z三种元素的电负性逐渐减小 |
| C.Z的最高价氧化物对应的水化物是强酸 | D.X、Z形成的化合物是离子化合物 |
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
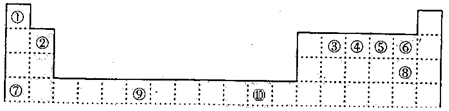
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | ① | ② | ③ | ④ | |
| 3 | | ⑤ | ⑥ | ⑦ | | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.酸性强弱: HI > HBr > HCl > HF | B.原子半径大小: Na > S > O |
| C.碱性强弱: KOH > NaOH > LiOH | D.还原性强弱: F- > Cl- > I- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 电离能/kJ·mol—1 | I1 | I2 | I3[来源:] | I4[来源: |
| X | 496 | 4562 | 6912 | 9543 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 578 | 1817 | 2745 | 11578 |
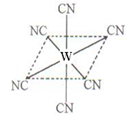
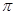 键数目为 。
键数目为 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com