
| ||
| 高温高压 |
| ||
| 高温高压 |
| ||
| ||


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、凡含有食品添加剂的食物对人体健康均有害,不可食用 |
| B、为防止电池中的重金属和酸碱等污染土壤和水体,应积极开发废电池的回收利用技术 |
| C、当今社会用量最大的合金是镁铝合金 |
| D、工业上用H2还原MgCl2的方法制取金属镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠与水反应 Na+H+=Na++H2 |
| B、用碳酸氢钠作为抗酸药来中和胃酸 H++HCO3-=H2O+CO2↑ |
| C、用熟石灰来中和酸性废水 Ca(OH)2+H+=Ca2++2H2O |
| D、用H2SO4来中和碱性废水 2H++2OH-=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
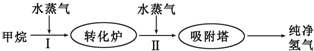

| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Li | B、F | C、Na | D、S |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| B、pH=8.3的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| C、常温下,pH=2的盐酸溶液中,由水电离出的c(H+)=1.0×10-12 mol/L |
| D、Na2CO3溶液中加水稀释后恢复至原温度,pH和Kw均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液的pH值:②>③>① |
| B、水电离出的c(OH-):③>①=② |
| C、①和③等体积混合后的溶液:c(CH3COOH)+c(CH3COO-)=0.1mol/L |
| D、②和③等体积混合后的溶液:c(Na+)=c(CH3COOH)+c(CH3COO-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com