
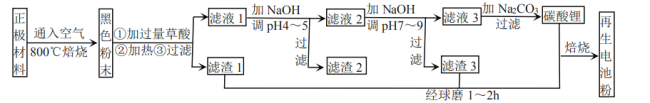
【题目】废旧锂离子电池正极材料的主要成分为碳棒和![]() ,另含少量
,另含少量![]() 、
、![]() 杂质。某厂按如图流程对废旧锂离子电池的正极进行回收再生。回答有关问题:
杂质。某厂按如图流程对废旧锂离子电池的正极进行回收再生。回答有关问题:
已知:①草酸电离常数:![]() ,
,![]() ;草酸的酸式盐以及草酸锂均可溶。
;草酸的酸式盐以及草酸锂均可溶。
②常温时,有关物质Ksp如下表(单位略):
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)通入空气,800℃焙烧目的是___________________________。
(2)已知![]() 中
中![]() 、
、![]() 、
、![]() 化合价相同,则它们的化合价为_________。
化合价相同,则它们的化合价为_________。
(3)加入草酸加热时,![]() 、
、![]() 、
、![]() 元素部分转化为
元素部分转化为![]() 、
、![]() 、
、![]() 沉淀,而另一部分以草酸的酸式盐形式进入溶液。写出
沉淀,而另一部分以草酸的酸式盐形式进入溶液。写出![]() 与草酸反应生成
与草酸反应生成![]() 沉淀的化学方程式_________。
沉淀的化学方程式_________。
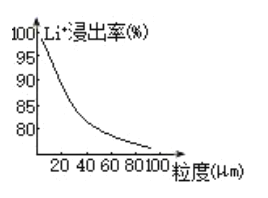
(4)焙烧后黑色粉的平均粒度(颗粒直径表示)与![]() 的浸出率关系如图所示,原因是___________。
的浸出率关系如图所示,原因是___________。
(5)滤液1加![]() 调pH为4~5目的是_____________________。
调pH为4~5目的是_____________________。
(6)滤液2调![]() 时,溶液中
时,溶液中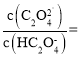 ___________。
___________。
【答案】除去正极材料中的碳 +3 ![]() 粒度越大,表面积(比表面积)越小,反应物接触面积就越小,反应速率越慢,且反应不充分 使
粒度越大,表面积(比表面积)越小,反应物接触面积就越小,反应速率越慢,且反应不充分 使![]() 和
和![]() 转化为氢氧化物沉淀除去
转化为氢氧化物沉淀除去 ![]()
【解析】
废旧锂离子电池正极材料的主要成分为碳棒和![]() ,另含少量
,另含少量![]() 、
、![]() 杂质,经800℃焙烧,将碳转化为二氧化碳;加入草酸加热时,
杂质,经800℃焙烧,将碳转化为二氧化碳;加入草酸加热时,![]() 、
、![]() 、
、![]() 元素部分转化为
元素部分转化为![]() 、
、![]() 、
、![]() 沉淀,而另一部分以草酸的酸式盐形式进入溶液;加入氢氧化钠调节pH除去三价铁,三价铝,再加碳酸钠沉淀Li+;最终焙烧,得可再生电池粉。
沉淀,而另一部分以草酸的酸式盐形式进入溶液;加入氢氧化钠调节pH除去三价铁,三价铝,再加碳酸钠沉淀Li+;最终焙烧,得可再生电池粉。
(1)经分析,通入空气,800℃焙烧目的是将正极材料中的碳转化为二氧化碳而除去,故答案为:除去正极材料中的碳;
(2) ![]() 中
中![]() 、
、![]() 、
、![]() 化合价相同,设为a,Li的化合价为+1,O为-2价,根据正负化合价的代数和为零,得
化合价相同,设为a,Li的化合价为+1,O为-2价,根据正负化合价的代数和为零,得![]() ,a=3,故答案为:+3;
,a=3,故答案为:+3;
(3) ![]() 与草酸反应生成
与草酸反应生成![]() 、
、![]() ,同时Co的化合价从+3变为+2,C的化合价要升高,从+3变为+4,生成CO2,故答案为:
,同时Co的化合价从+3变为+2,C的化合价要升高,从+3变为+4,生成CO2,故答案为:![]() ;
;
(4)由图分析以及接触面积与化学反应速率的关系,可知,粒度越大,表面积(比表面积)越小,反应物接触面积就越小,反应速率越慢,且反应不充分,故答案为:粒度越大,表面积(比表面积)越小,反应物接触面积就越小,反应速率越慢,且反应不充分;
(5). 通过氢氧化铁的电离方程式和溶度积可算出Fe3+离子浓度为10-5mol/L时,OH-的浓度为2×10-11![]() 和
和![]() 转化为氢氧化物沉淀除去;
转化为氢氧化物沉淀除去;
(6) 溶液中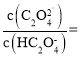
 ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列说法不能够用勒夏特勒原理来解释的是
A. 实验室用排饱和食盐水的方法收集氯气
B. 溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入硝酸银溶液后(AgBr是淡黄色沉淀),溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后(AgBr是淡黄色沉淀),溶液颜色变浅
C. SO2催化氧化制SO3的过程中使用过量的氧气,以提高二氧化硫的转化率
D. 恒温、恒压条件下,在2NO2![]() N2O4平衡体系中充入He后,体系颜色变浅
N2O4平衡体系中充入He后,体系颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是

A. 用石墨作阳极,铁作阴极
B. 阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O
C. 阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH-
D. 除去CN-的反应:2CN-+ 5ClO- + 2H+ = N2↑ + 2CO2↑ + 5Cl-+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质.以下是制备精盐的实验方案,各步操作流程如下:
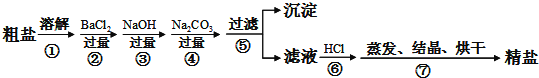
(1)第②步操作的目的是除去粗盐中的______(填化学式)。
(2)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、CaCO3、___(填化学式)。
(3)在第③步操作中,选择的除杂试剂不能用KOH代替NaOH,理由是________。
(4)写出第⑥步反应的离子方程式_______________,______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某元素的价类二维图,其中A为正盐,X是一种强碱,通常条件下Z是无色液体,E的相对分子质量比D大16,各物质的转化关系如图所示。下列说法错误的是
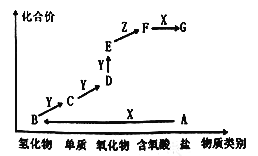
A. A作肥料时不适合与草木灰混合施用
B. 同主族元素的氢化物中B的沸点最低
C. C一般用排水法收集
D. D→E的反应可用于检验D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和CO2是碳的两种氧化物,请计算:
(1)在标准状况下,5.6LCO的物质的量是__________,质量是__________。
(2)11gCO2在标准状况下的体积是__________。
(3)相同物质的量的CO和CO2所含氧原子个数之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表第四周期Ⅷ族,其基态原子中未成对电子个数为___________。
(2)基态Fe3+的核外电子排布式___________
(3)铁氧体是一种磁性材料,工业上制备时常采用水解法,制备时常加入尿素(CO(NH2)2)、醋酸钠等碱性物质。尿素分子中所含非金属元素的电负性由大到小的顺序是___________,分子中σ键与π键的数目之比为___________。醋酸钠中碳原子的杂化类型___________。
(4)铁氧体也可使用沉淀法,制备时常加入氨(NH3)、联氨(N2H4)等弱碱,已知氨(NH3熔点:-77.8%℃、沸点:-33.5%℃),联氨(N2H4熔点:2℃、沸点:113.5°C)解释其熔沸点高低的主要原因______________________。
(5)Co(NH3)5BrSO4可形成两种钴的配合物,已知Co3+的配位数为6,为确定钻的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,则第一种配合物的配体为___________。在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为___________。

(6)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如上图所示,则该物质的化学式为___________。若品体密度为dg·cm-3,则晶胞中最近的两个碳原子的距离为___________pm(阿伏加德罗常数的值用NA表示,写出简化后的计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物中,可能含有下列离子中的几种:K+、NH4+、Mg2+、Ba2+、Cl-、SO42-、CO32-,将该混合物溶于水后得澄清溶液,现取三份各100mL该溶液分别进行如下实验:
(1)在一份溶液中加入AgNO3溶液,有白色沉淀生成;
(2)在另一份溶液中加入足量的NaOH溶液并加热,收集到1.12L气体(标准状况下);
(3)在第三份溶液中加入足量的BaCl2溶液有沉淀生成,经称量其质量为6.27g,在该沉淀中 加入足量的盐酸,沉淀部分溶解,剩余固体质量为2.33g。
根据上述实验回答下列问题:
①溶液中一定不存在的离子是:_______________________________;
②溶液中一定存在的阴离子有:_______________;其物质的量浓度分别为:_____________;
③推断K+是否存在:(填“是 ”或“否”)________________,其物质的量浓度为:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:① Fe + H2SO4(稀) ![]() FeSO4 + H2↑
FeSO4 + H2↑
② CuO + H2 ![]() Cu + H2O
Cu + H2O
③ MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑ + 2H2O
MnCl2 + Cl2↑ + 2H2O
试回答下列问题:
(1)反应①中_________作氧化剂(填化学式),___________是氧化产物(填化学式);若有2mol Fe完全反应,转移的电子数为________ mol。
(2)用双线桥法表示反应②电子转移的方向和数目:________
(3)反应③中HCl体现了_________________性和_______________性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com