


分析 (1)ClO2发生器中的反应为氯酸钠与二氧化硫在浓硫酸作用下发生氧化还原反应,而硫磺、浓硫酸也可以生成二氧化硫,所以可用硫磺、浓硫酸代替原料中的SO2;
(2)反应结束后,发生器中仍有少量ClO2,用空气可以将其排出,确保其被充分吸收;
(3)吸收器中双氧水与ClO2在碱性条件下发生氧化还原反应生成NaClO2,根据电荷守恒和元素守恒可写出离子方程式,为了提高ClO2的利用率及防止H2O2分解,反应温度不能高于高于5℃;
(4)①二氧化硫能被氢氧化钠溶液或高锰酸钾溶液吸收;
②D中收集到的气体可使带余烬的木条复燃,说明有氧气产生,所以B中发生的反应可能为二氧化硫与过氧化钠反应生成亚硫酸钠和氧气.
解答 解:(1)ClO2发生器中的反应为氯酸钠与二氧化硫在浓硫酸作用下发生氧化还原反应,而硫磺、浓硫酸也可以生成二氧化硫,反应的方程式为S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O,所以可用硫磺、浓硫酸代替原料中的SO2,
故答案为:S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O;
(2)反应结束后,发生器中仍有少量ClO2,用空气可以将其排出,确保其被充分吸收,
故答案为:驱赶出ClO2,确保其被充分吸收;
(3)吸收器中双氧水与ClO2在碱性条件下发生氧化还原反应生成NaClO2,反应的离子方程式为2ClO2+2OH-+H2O2=2ClO2-+O2+2H2O,为了提高ClO2的利用率及防止H2O2分解,反应温度不能高于高于5℃,
故答案为:2ClO2+2OH-+H2O2=2ClO2-+O2+2H2O;提高ClO2的利用率及防止H2O2分解;
(4)①二氧化硫能被氢氧化钠溶液或高锰酸钾溶液吸收,所以C中盛放的试剂为NaOH溶液(或KMnO4溶液),
故答案为:NaOH溶液(或KMnO4溶液);
②D中收集到的气体可使带余烬的木条复燃,说明有氧气产生,所以B中发生的反应可能为二氧化硫与过氧化钠反应生成亚硫酸钠和氧气,反应的方程式为2Na2O2+2SO2=2Na2SO3+O2,
故答案为:2Na2O2+2SO2=2Na2SO3+O2.
点评 本题考查物质的制备实验的工业设计,题目难度中等,本题注意把握物质的性质,从质量守恒的角度以及氧化还原反应的特点判断生成物,为解答该题的关键,也是易错点.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 操作及现象 | 溶液 |
| A | 通入CO2,溶液变浑浊 | 饱和Na2CO3溶液 |
| B | 通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失 | Na2SiO3溶液 |
| C | 通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 | Ca(ClO)2溶液 |
| D | 通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失,再加入足量NaOH溶液,又变浑浊 | 澄清石灰水 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 试剂 | T1/℃ | T2/℃ | T2/℃ |
| Ha2CO2 | 23.3 | 20.0 | 23.7 |
| HaCO2 | 18.5 | 20.0 | 20.8 |
| 温度 溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
| Ha2CO2 | 12.5g | 21.5g | 39.7g | 40.g |
| HaHCO2 | 8.1g | 9.6g | 11.1g | 12.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 仪器及装置图 |  |  |  |  |  |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:3.4 | B. | 1:1.7 | C. | 2.6:1 | D. | 4.6:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
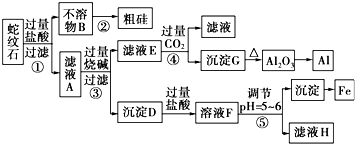
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com