
只用下列试剂中的一种,就能将FeCl3、NH4Cl和NaCl三种溶液区别开的是( )
A.KSCN溶液 B.BaCl2溶液
C.AgNO3溶液 D.NaOH溶液
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
甲、乙、丙、丁是原子序数依次增大的四种短周期元素,A、B、C、D、E是由其中的两种或三种元素组成的化合物,F是由丙元素形成的单质。已知:A+B―→D+F,A+C―→E+F;0.1 mol·L-1 D溶液的pH为13(25 ℃)。下列说法正确的是( )
A.原子半径:丁>丙>乙>甲
B.1 mol A与足量B完全反应共转移了2 mol电子
C.丙元素在周期表中的位置为第二周期ⅣA族
D.A中既有离子键又有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在比较酸的强弱时,必须考虑两方面:一是电离出氢离子的能力,二是溶剂接受氢离子的能力.比如HCl在水中是强酸,在冰醋酸中就是弱酸;而HAc在水中是弱酸,在液氨中却是强酸,就是因为接受氢离子的能力:NH3>H2O>HAc.下列关于酸性强弱的说法正确的是( )
|
| A. | 在A溶剂中,甲的酸性大于乙;在B的溶剂中,甲的酸性可能小于乙 |
|
| B. | 比较HCl、H2SO4、HClO4、HNO3酸性的强弱,用水肯定不可以,用冰醋酸可能可以 |
|
| C. | HNO3在HClO4中是酸,在H2SO4中可能是碱 |
|
| D. | 比较HCN与HAc酸性的强弱,用水肯定可以,用液氨肯定也可以 |
查看答案和解析>>
科目:高中化学 来源: 题型:
中药狼把草的成分之一M具有消炎杀菌作用,M的结构如图所示。下列叙述正确的是( )
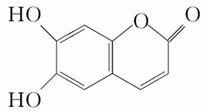
A.M的相对分子质量是180
B.1 mol M最多能与2 mol Br2发生反应
C.M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4
D.1 mol M与足量NaHCO3反应能生成2 mol CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
A.实验室制NH3:NH +OH-
+OH-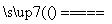 NH3↑+H2O
NH3↑+H2O
B.NaOH与NH4Cl溶液混合加热:NH +OH-
+OH-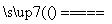 NH3·H2O
NH3·H2O
C.氨水中加盐酸:NH3·H2O+H+===NH +H2O
+H2O
D.氨气通入稀H2SO4中:NH3+H+===NH
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)鉴别KCl溶液和K2CO3的试剂是________,离子方程式为
________________________________________________________________________。
(2)除去FeCl2溶液中混有的FeCl3用________,离子方程式为
________________________________________________________________________。
(3)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)________________________________________________________________
________________________________________________________________________。
(4)有A、B、C、D四种无色气体,①A能使湿润的红色石蕊试纸变蓝;②一定条件下,A可以与B反应生成C,C遇空气变为红棕色;③D与A混合生成白烟;④D的浓溶液与软锰矿(主要成分是MnO2)在加热条件下反应可制取黄绿色气体E;按要求回答下列问题:
a.写出实验室制A气体的化学反应方程式
________________________________________________________________________。
b.写出②化学反应方程式
_________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是
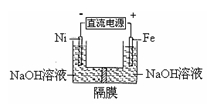
A.铁是阳极,电极反应为Fe-6e-+4H2O=FeO42-+ 8H+
B.电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极
C.若隔膜为阴离子交换膜,则OH-自右向左移动
D.电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物A可作为植物生长调节剂,为便于使用,通常将其制成化合物
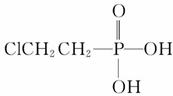 D( ),D在弱酸性条件下会缓慢释放出A。合成D的一种
D( ),D在弱酸性条件下会缓慢释放出A。合成D的一种
方法及各物质间转化关系如图所示:
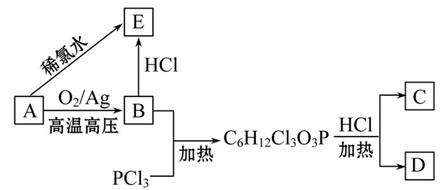
请回答下列问题:
(1)A的名称是_________,A与氯气反应可生成C,C的名称是_________;
(2)经测定E中含有氯元素,且E可以与乙酸发生酯化反应,则E的结构简式为_________,由A直接生成E的反应类型是_________;
(3)在弱酸性条件下,D与水反应生成A的化学方程式为______________________;
(4)写出E的两个同分异构体的结构简式__________________。
A可作为植物生长调节剂,则A为乙烯;
由第(2)问“E中含有氯元素,且E可以与乙酸发生酯化反应”知E中含有氯元素和羟基,结合E可以由乙烯与稀氯水反应得到推知E为ClCH2CH2OH,可以认为是CH2=CH2与HO—Cl加成的产物。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,将铁棒和石墨棒插入1 L 1 mol·L-1食盐水中。下列说法正确的是 ( )
A.若电键K与N连接,铁被保护不会腐蚀
B.若电键K与N连接,正极反应式是4OH--4e-====2H2O+O2↑
C.若电键K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜
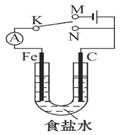 D.若电键K与M连接,当两极共产生28 L(标准状况)气体时,生成了1 mol NaOH
D.若电键K与M连接,当两极共产生28 L(标准状况)气体时,生成了1 mol NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com