
| 离子 | Cu2+ | H+ | Cl- | SO$\stackrel{2-}{4}$ |
| c/(mol•L-1) | 1 | 4 | 4 | 1 |
分析 (1)精炼铜时,阴极材料是纯铜,阴极为铜离子得电子发生还原反应;
(2)氯碱工业电解饱和食盐水的总反应方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;
(3)锰离子在阳极失电子生成MnO2;
(4)根据原电池原理,正极O2得到电子生成负极O2-;依据电解原理和溶液中离子放电顺序,结合电子守恒和电极反应计算得到;
解答 解:(1)精炼铜时,阴极材料是纯铜,阴极为铜离子得电子发生还原反应,反应式为Cu2++2e-=Cu,故答案为:纯铜,Cu2++2e-=Cu;
(2)氯碱工业电解饱和食盐水的总反应方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;
(3)锰离子在阳极失电子生成MnO2,反应式为:Mn2++2H2O-2e-=MnO2+4H+,故答案为:Mn2++2H2O-2e-=MnO2+4H+;
(4)燃料电池,电池的一个电极通 入空气,另一个电极通入甲醇气体,电解质是掺入了 Y2O3的ZrO2晶体,在高温下它能传导O2-离子,根据原电池原理,正极O2得到电子生成负极O2-:O2+4e-=2O2-,电解一段时间后,当两极收集到相同体积(相词条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),100ml溶液中含有c(Cu2+)=1mol/L,c(H+)=4mol/L,c(Cl-)=4mol/L,c(SO42-)=1mol/L;
阳极氯气和阴极氢气相同,设阳极生成的氧气物质的量为x,阴极上也应生成氢气物质的量x
阳极电极反应为:2Cl--2e-=Cl2↑,4OH--4e-=2H2O+O2↑,
0.4mol 0.4mol 0.2mol 4x x
阴极电极反应为:Cu2++2e-=Cu,
0.1mol 0.2mol 0.1mol
2H++2e-=H2↑; 2H++2e-=H2↑;
0.4mol 0.4mol 0.2mol 2x x
依据电子守恒0.4+4x=0.2+0.4+2x
x=0.1mol
阳极上收集到氧气的物质的量0.1mol;
故答案为:O2+4e-=2O2-;0.1.
点评 本题考查了原电池和电解池原理的分析应用,氧化还原反应的实质,掌握原理是解题关键,题目难度中等.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:解答题
 科研生产中常涉及碳的化合物.请回答下列问题:
科研生产中常涉及碳的化合物.请回答下列问题:| 反应时间/min | N[CO(g)]mol | N[H2O(g)]mol |
| 0 | 1.8 | 0.9 |
| t1 | 1.2 | |
| t2 | y | 0.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定温度下,在2L的恒容密闭容器内发生的反应中M、N的物质的量随反应时间变化的曲线如图所示.请回答下列问题:
一定温度下,在2L的恒容密闭容器内发生的反应中M、N的物质的量随反应时间变化的曲线如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
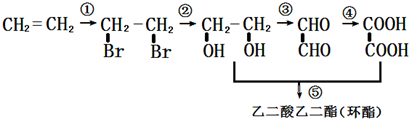
 ;
; +H2O,;
+H2O,; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 压强P1<P2 | B. | a+b<c+d | C. | T1<T2 | D. | △H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2 | B. | HNO3 | C. | Na2O2 | D. | H2O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com