
| 气化反应式 | 1gK | ||
| 700K | 900K | 1200K | |
| C(s)+H2O(g)=CO(g)+H2(g) | -2.64 | -0.39 | 1.58 |
| C(s)+2H2O(g)=CO2(g)+2H2(g) | -1.67 | -0.03 | 1.44 |
分析 (1)设①C(s)+H2O(g)=CO(g)+H2(g)的平衡常数为K1,
②C(s)+2H2O(g)=CO2(g)+2H2(g)的平衡常数为K2,
则②-①可得:CO(g)+H2O(g)?CO2(g)+H2(g),故平衡常数K=$\frac{{K}_{2}}{{K}_{1}}$;
(2)已知CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,可得热化学方程式:
①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
由盖斯定律,②-①可得:CH3OH(l)+O2(g)=CO(g)+2 H2O(l);
(3)①改变条件增大反应速率,可以采取加入催化剂、升温、加压、增大浓度等措施,且提高CO的转化率应使平衡向正反应方向移动,但不能只增大CO的浓度,否则CO转化率为降低,结合平衡移动原理分析解答;
②同温同压下,气体密度之比等于平均相对分子质量之比,平衡时混合气体密度增大,说明混合气体物质的量减小,反应正向进行建立平衡;
平衡时混合气体密度是同温同压下起始时的1.6倍,则平衡时混合气体物质的量为(3mol+3mol+1mol+1mol)×$\frac{1}{1.6}$=5mol,结合差量法计算解答;
(4)混合后溶液中c(Ba2+)=0.5b mol/L,根据电荷守恒:2c(Ba2+)+c(H+)=c(CH3COO-)+c(OH-),溶液中存在2c(Ba2+)=c(CH3COO-),则c(H+)=c(OH-)=10-7 mol/L,溶液中c(CH3COO-)=b mol/L,由微粒守恒可知溶液中c(CH3COOH)=(0.5a-b )mol/L,再根据Ka=$\frac{c({H}^{+})×c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$计算.
解答 解:(1)设①C(s)+H2O(g)=CO(g)+H2(g)的平衡常数为K1,
②C(s)+2H2O(g)=CO2(g)+2H2(g)的平衡常数为K2,
则②-①可得:CO(g)+H2O(g)?CO2(g)+H2(g),故平衡常数K=$\frac{{K}_{2}}{{K}_{1}}$,
700K时:lgK=-1.67-(-2.64)=0.97,900K时:lgK=-0.03-(-0.39)=0.36,随温度升高lgK减小,则平衡常数减小,说明升高平衡逆向移动,则正反应为放热反应,故△H<0,
故答案为:<;0.36;
(2)已知CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,可得热化学方程式:
①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
由盖斯定律,②-①可得:CH3OH(l)+O2(g)=CO(g)+2 H2O(l),则该反应的反应热△H=-726.5kJ•mol-1-(-283.0kJ•mol-1)=-443.5kJ•mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l);△H=-443.5kJ/mol;
(3)①a.正反应为放热反应,降低温度,平衡向正反应方向移动,CO的转化率增大,但反应速率减小,故a错误;
b.加入催化剂,反应速率增大,不影响平衡移动,CO的转化率不变,故b错误;
c.正反应为气体体积减小的反应,缩小容器体积,压强增大,反应速率增大,平衡向正反应方向移动,CO的转化率增大,故c正确;
d.增加H2的浓度,反应速率增大,平衡向正反应移动,CO的转化率增大,故d正确;
e.增加CO的浓度,反应速率增大,平衡向正反应移动,但CO的转化率减小,故e错误;
故答案为:cd;
②同温同压下,气体密度之比等于平均相对分子质量之比,平衡时混合气体密度增大,说明混合气体物质的量减小,反应正向进行建立平衡,故v(正)>v(逆),
平衡时混合气体密度是同温同压下起始时的1.6倍,则平衡时混合气体物质的量为(3mol+3mol+1mol+1mol)×$\frac{1}{1.6}$=5mol,则:
3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△n=4
开始(mol):3 3 1 1
变化(mol):2.25 2.25 0.75 0.75 8-5=3
平衡(mol):0.75 0.75 1.75 1.75
平衡时CO的物质的量分数为$\frac{0.75mol}{5mol}$×100%=15%,
故答案为:>;15%.
混合后溶液中c(Ba2+)=0.5b mol/L,根据电荷守恒:2c(Ba2+)+c(H+)=c(CH3COO-)+c(OH-),溶液中存在2c(Ba2+)=c(CH3COO-),则c(H+)=c(OH-)=10-7 mol/L,溶液中c(CH3COO-)=b mol/L,由微粒守恒可知溶液中c(CH3COOH)=(0.5a-b )mol/L,电离平衡常数Ka=$\frac{c({H}^{+})×c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=$\frac{1{0}^{-7}×b}{(0.5a-b)}$=$\frac{2b}{a-2b}$×10-7 mol•L-1,
故答案为:$\frac{2b}{a-2b}$×10-7 mol•L-1.
点评 本题考查化学平衡计算与影响因素、反应速率、平衡常数应用、反应热计算、电离平衡常数等,属于拼合型题目,需学生具备扎实的基础,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应后溶液中不存在任何沉淀,所以反应前后Zn2+的浓度不变 | |
| B. | 沉淀溶解后,将生成配合离子[Zn(NH3)4]2+ | |
| C. | 用硝酸锌溶液代替硫酸锌溶液进行实验,能观察到同样的现象 | |
| D. | 在[Zn(NH3)4]2+离子中,NH3给出孤对电子,Zn2+提供空轨道 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
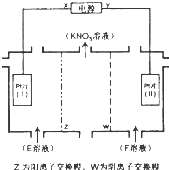
| A. | X为负极,F溶液NaNO3溶液 | |
| B. | 电解一段时间,往Pt片(I)附近滴入酚酞,溶液变红 | |
| C. | 电解总反应方程式为:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ | |
| D. | 理论上,当得到0.1molKNO3时,Pt片(Ⅱ)上生成标准状况下为1.12L的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
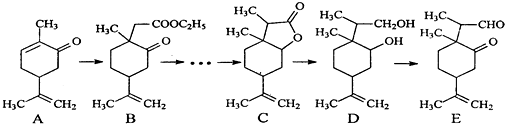
 .
.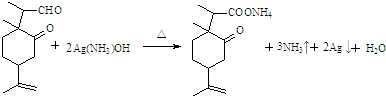 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用天然气可制得以H2、CO等为主要组成的工业原料合成气,反应为:CH4(g)+H2O(g)?CO(g)+3H2(g).
利用天然气可制得以H2、CO等为主要组成的工业原料合成气,反应为:CH4(g)+H2O(g)?CO(g)+3H2(g).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4 | |
| B. | NaCl溶液能导电是因为溶液中有自由移动的Na+和Cl- | |
| C. | 进行焰色反应,连续做两个样品时,应将铂丝用硫酸洗净并灼烧到无特殊焰色 | |
| D. | 浓硫酸不慎沾在皮肤上,应立即用干布拭去,然后用水冲洗,最后再涂上3%-5%的小苏打溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | BaCl2与K2CO3溶液反应 | B. | CO2与Ba(OH)2溶液反应 | ||
| C. | Ba(NO3)2与Na2CO3溶液反应 | D. | Ba(OH)2与少量NaHCO3溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
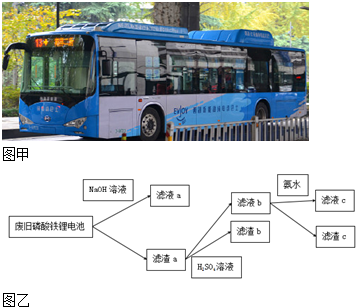
| A. | 向滤液a中加入适量H2SO4溶液,可以得到白色沉淀 | |
| B. | 滤液b中加入氨水的目的是使Fe3+沉淀,滤渣c为红褐色 | |
| C. | 要将Li从溶液中析出,可在滤液c中加入足量Na2CO3溶液,加热浓缩,冷却结晶 | |
| D. | 图中的氨水可以用适量NaOH溶液代替 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com