
Ęū³µĪ²ĘųÖŠµÄÖ÷ŅŖĪŪČ¾ĪļŹĒNOŗĶCO”£ĪŖ¼õĒį“óĘųĪŪČ¾£¬ČĖĆĒĢį³öĶعżŅŌĻĀ·“Ó¦Ą““¦ĄķĘū³µĪ²Ęų£ŗ
£Ø1 £©2NO(g)+2CO(g)
£©2NO(g)+2CO(g) 2CO2(g)+N2(g)”÷H=©746.5kJ•mol£1£ØĢõ¼žĪŖŹ¹ÓĆ“ß»Æ¼Į£©
2CO2(g)+N2(g)”÷H=©746.5kJ•mol£1£ØĢõ¼žĪŖŹ¹ÓĆ“ß»Æ¼Į£©
ŅŃÖŖ£ŗ2C(s)+O2(g) 2CO(g)”÷H=©221.0kJ•mol£1
2CO(g)”÷H=©221.0kJ•mol£1
C(s)+O2(g) CO2(g)”÷H=©393.5kJ•mol£1
CO2(g)”÷H=©393.5kJ•mol£1
ŌņN2(g)+O2(g)=2NO(g) ”÷H = kJ•mol£1”£
£Ø2£©T ”ęĻĀ£¬ŌŚŅ»ČŻ»ż²»±äµÄĆܱÕČŻĘ÷ÖŠ£¬ĶØČėŅ»¶ØĮæµÄNOŗĶCO£¬ÓĆĘųĢå“«øŠĘ÷²āµĆ²»Ķ¬Ź±¼äNOŗĶCOµÄÅضČČēĻĀ±ķ
Ź±¼ä/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/10£4 mol/L | 10.0 | 4.50 | c1 | 1.50 | 1.00 | 1.00 |
c(CO)/10£3 mol/L | 3.60 | 3.05 | c2 | 2.75 | 2.70 | 2.70 |
Ōņc2ŗĻĄķµÄŹżÖµĪŖ £ØĢī×ÖÄø±źŗÅ£©”£
A£®4.20 B£®4.00 C£®2.95 D£®2.80
£Ø3£©½«²»Ķ¬ĪļÖŹµÄĮæµÄH2O(g)ŗĶCO(g)·Ö±šĶØČėĢå»żĪŖ2 LµÄŗćČŻĆܱÕČŻĘ÷ÖŠ£¬½ųŠŠ·“Ó¦£ŗH2O(g)+CO(g) CO2(g)+H2(g)£¬µĆµ½ČēĻĀČż×鏿¾Ż£ŗ
CO2(g)+H2(g)£¬µĆµ½ČēĻĀČż×鏿¾Ż£ŗ
ŹµŃé×é | ĪĀ¶Č/”ę | ĘšŹ¼Įæ/mol | Ę½ŗāĮæ/mol | “ļµ½Ę½ŗāĖłŠčŹ±¼ä/min | ||
H2O | CO | CO | H2 | |||
i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
iii | 900 | a | b | c | d | t |
Čōa=2£¬b=1£¬Ōņc= £¬“ļĘ½ŗāŹ±ŹµŃé×éiiÖŠH2O(g)ŗĶŹµŃé×éiiiÖŠCOµÄ×Ŗ»ÆĀŹµÄ¹ŲĻµĪŖ¦Įii£ØH2O£© ¦Įiii£ØCO£©£ØĢī”°£¼”±”¢”°£¾”±»ņ”°=”±£©”£
£Ø4£©¶ž¼×ĆŃŹĒĒå½ąÄÜŌ“£¬ÓĆCOŌŚ“߻ƼĮ“ęŌŚĻĀÖʱø¶ž¼×Ćѵķ“Ó¦ŌĄķĪŖ£ŗ2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)£¬ŅŃÖŖŅ»¶ØĢõ¼žĻĀ£¬øĆ·“Ó¦ÖŠCOµÄĘ½ŗā×Ŗ»ÆĀŹĖęĪĀ¶Č”¢Ķ¶ĮĻ±Č
CH3OCH3(g)+H2O(g)£¬ŅŃÖŖŅ»¶ØĢõ¼žĻĀ£¬øĆ·“Ó¦ÖŠCOµÄĘ½ŗā×Ŗ»ÆĀŹĖęĪĀ¶Č”¢Ķ¶ĮĻ±Č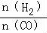 µÄ±ä»ÆĒśĻßČēĶ¼1ĖłŹ¾”£
µÄ±ä»ÆĒśĻßČēĶ¼1ĖłŹ¾”£

¢Ł a”¢b”¢c°““ӓ󵽊”µÄĖ³ŠņÅÅŠņĪŖ ”£
¢Ś øł¾ŻĶ¼ĻóæÉŅŌÅŠ¶ĻøĆ·“Ó¦ĪŖ ·“Ó¦£ØĢīĪüČČ»ņ·ÅČČ£©”£
£Ø5£©CO·ÖĪöŅĒµÄ“«øŠĘ÷æɲā¶ØĘū³µĪ²ĘųŹĒ·ń·ūŗĻÅŷűź×¼£¬øĆ·ÖĪöŅĒµÄ¹¤×÷ŌĄķĄąĖĘÓŚČ¼ĮĻµē³Ų £¬ĘäÖŠµē½āÖŹŹĒŃõ»ÆīĘ£ØY2O3£©ŗĶŃõ»ÆļÆ£ØZrO2£©¾§Ģ壬ÄÜ“«µ¼O2£”£
£¬ĘäÖŠµē½āÖŹŹĒŃõ»ÆīĘ£ØY2O3£©ŗĶŃõ»ÆļÆ£ØZrO2£©¾§Ģ壬ÄÜ“«µ¼O2£”£
¢Ł øŗ¼«µÄµē¼«·“Ó¦Ź½ĪŖ ”£
¢Ś ŅŌÉĻŹöµē³ŲĪŖµēŌ“£¬Ķعżµ¼ĻßĮ¬½Ó³ÉĶ¼2”£ČōX”¢YĪŖŹÆÄ«£¬aĪŖ2 L 0.1 mol/L KClČÜŅŗµē½āŅ»¶ĪŹ±¼äŗó£¬Č”25 mL ÉĻŹöµē½āŗóµÄČÜŅŗ£¬µĪ¼Ó0.4 mol/L“×ĖįµĆµ½Ķ¼3ĒśĻߣز»æ¼ĀĒÄÜĮæĖšŹ§ŗĶĘųĢåČÜÓŚĖ®£¬ČÜŅŗĢå»ż±ä»ÆŗöĀŌ²»¼Ę£©”£øł¾ŻĶ¼2¼ĘĖć£¬ÉĻŹöµē½ā¹ż³ĢÖŠĻūŗÄŅ»Ńõ»ÆĢ¼µÄÖŹĮæĪŖ g”£

| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ±ź×¼×“æöĻĀ£¬22.4LH2Oŗ¬ÓŠµÄ·Ö×ÓŹżĪŖ1NA | |
| B£® | ³£ĪĀ³£Ń¹ĻĀ£¬7.1g Cl2Óė×ćĮæµÄFe³ä·Ö·“Ó¦£¬×ŖŅʵĵē×ÓŹżÄæĪŖ0.3 NA | |
| C£® | Ķس£×“æöĻĀ£¬NA øöCO2·Ö×ÓÕ¼ÓŠµÄĢå»żĪŖ22.4L | |
| D£® | ĪļÖŹµÄĮæÅضČĪŖ0.5mol/LµÄMgCl2ČÜŅŗÖŠ£¬1LČÜŅŗÖŠŗ¬ÓŠCl-øöŹżĪŖ1 NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 £®
£® £®
£® $\stackrel{Br_{2}/CCl_{4}}{”ś}$
$\stackrel{Br_{2}/CCl_{4}}{”ś}$ $”ś_{”÷}^{NaOH/C_{2}H_{5}OH}$
$”ś_{”÷}^{NaOH/C_{2}H_{5}OH}$ £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017ѧğøŹĖąŹ”ø߶žÉĻ10ŌĀŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
“ÓÖ²Īļ»ØÖÖŠĢįČ”µÄŅ»ÖÖÓŠ»śHIn£¬æÉ×öĖį¼īÖøŹ¾¼Į£¬ŌŚĖ®ČÜŅŗÖŠ“ęŌŚµēĄėĘ½ŗā£ŗHIn(ŗģÉ«)  H£«£«In£(»ĘÉ«)£¬¶ŌÉĻŹöĘ½ŗā½āŹĶ²»ÕżČ·µÄŹĒ
H£«£«In£(»ĘÉ«)£¬¶ŌÉĻŹöĘ½ŗā½āŹĶ²»ÕżČ·µÄŹĒ
A£®ÉżøßĪĀ¶ČĘ½ŗāĻņÕż·½ĻņŅʶÆ
B£®¼ÓČėŃĪĖįŗóĘ½ŗāĻņÄę·½ĻņŅĘ¶Æ£¬ČÜŅŗĻŌŗģÉ«
C£®¼ÓČėNaOHČÜŅŗŗóĘ½ŗāĻņÕż·½ĻņŅĘ¶Æ£¬ČÜŅŗĻŌ»ĘÉ«
D£®¼ÓČėNaHSO4ČÜŅŗŗóĘ½ŗāĻņÕż·½ĻņŅĘ¶Æ£¬ČÜŅŗĻŌ»ĘÉ«
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017ѧğøŹĖąŹ”ø߶žÉĻ10ŌĀŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
°±Ė®ÖŠĖłŗ¬µÄ·Ö×ÓŗĶĄė×ÓÓŠ 
¢ŁNH4+ ¢ŚH2O ¢ŪNH3 ¢ÜNH3”¤H2O ¢ŻH£« ¢ŽOH£
A£®¢Ł¢Ś¢Ū B£®¢Ś¢Ū¢Ü¢Ż C£®¢Ś¢Ū¢Ü¢Ż¢Ž D£®¢Ł¢Ś¢Ū¢Ü¢Ż¢Ž
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2017½ģ°²»ÕŹ”»ĘɽŹŠøßČżÉĻŌĀ漶ž»Æѧ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ijĶ¬Ń§×é×°ĮĖČēĶ¼ĖłŹ¾µÄµē»ÆѧװÖĆ£¬ĘäÖŠµē¼«IĪŖAl£¬ĘäĖü¾łĪŖCu£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
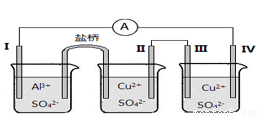
A£®×°Al2(SO4)3 ČÜŅŗµÄÉÕ±ŹĒŌµē³Ų£¬ĘäÓąĮ½øöĪŖµē½ā£Øµē¶Ę£©³Ų
B£®ŃĪĒÅÖŠµē×Ó“ÓÓŅ²ąĮ÷Ļņ×ó²ą
C£®µē¼«IIÖš½„Čܽā
D£®µē¼«IVµÄµē¼«·“Ó¦£ŗCu2+ + 2e£ = Cu
²éæ““š°øŗĶ½āĪö>>
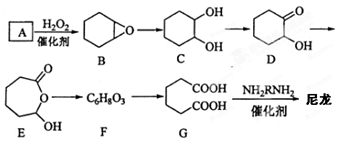
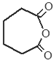
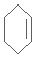
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2017½ģ°²»ÕŹ”»ĘɽŹŠøßČżÉĻŌĀ漶ž»Æѧ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
Cyrneine A¶ŌÖĪĮĘÉń¾ĻµĶ³¼²²”ÓŠ×ÅŗÜŗƵÄĮĘŠ§”£æÉÓĆĻćĒŪĶŖ¾¹ż¶ą²½·“Ó¦ŗĻ³É£ŗ £¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø £©
£¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø £©
A£®ĻćĒŪĶŖµÄ·Ö×ÓŹ½ĪŖC10H14O
B£®Cyrneine AæÉŅŌ·¢Éś¼Ó³É·“Ó¦”¢ĻūČ„·“Ó¦ŗĶŃõ»Æ·“Ó¦
C£®ĻćĒŪĶŖŗĶCyrneine A¾łÄÜŹ¹ĖįŠŌKMnO4ČÜŅŗĶŹÉ«
D£®ÓėĻćĒŪĶŖ»„ĪŖĶ¬·ÖŅģ¹¹Ģ壬·Ö×ÓÖŠÓŠ4ÖÖ²»Ķ¬»Æѧ»·¾³µÄĒāŌ×ӵķӥą»ÆŗĻĪļ¹²ÓŠ3ÖÖ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x£ØHI£© | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x£ØHI£© | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
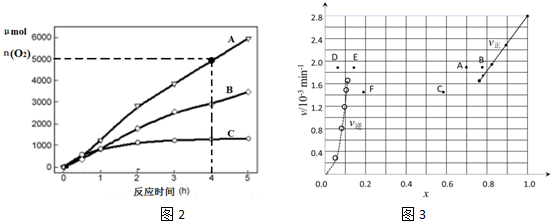
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com