
【题目】钼及其合金在冶金、环保和航天等方面有着广泛的应用。
(l)钼酸钠晶体(Na2MoO4·2H20)可用于制造阻燃剂和无公害型冷却水系统的金属缓蚀剂。Na2MoO4中Mo的化合价为____。在碱性条件下,将钼精矿(主要成分为MoS2)加入NaClO溶液中,也可以制备钼酸钠,该反应的离子方程式为________。
(2)已知:
①2Mo(s)+3O2(g)=2MoO3(s)△H1
②2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g)△H2
③MoS2(s)+2O2(g)=Mo(s)+2SO2(g)△H3
则△H3=_________(用含△H1、△H2的代数式表示)。
(3)碳酸钠作固硫剂并用氢还原辉钼矿的原理为:MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s)+2CO(g)+4H2O(g)+2Na2S(s)△H。实验测得平衡时的有关变化曲线如图所示。
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s)△H。实验测得平衡时的有关变化曲线如图所示。

图1:温度与平衡时气体成分的关系 图2:正、逆反应的平衡常数(K)与温度(T)的关系
①一定温度下,在体积为固定的密闭容器中进行上述反应,下列能说明反应达到了平衡状态的是____(填序号)。
A.2v正(H2)=v逆(CO)
B.CO体积分数保持不变
C.混合气体的平均相对分子质量不再变化
D.△H不再变化
②图1中A点对应的平衡常数Kp=__(已知A点压强为0.lMPa,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③综合上述分析得到:图2中,其中表示逆反应的平衡常数(K逆)的曲线是____(填“A”或“B”),T1对应的平衡常数为____。
【答案】 +6 MoS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O ![]() BC 4×10-4 B 1.0
BC 4×10-4 B 1.0
【解析】分析:(1)根据正负价代数和为0解答;根据反应物生成物结合守恒法书写离子方程式;
(2)根据盖斯定律解答;
(3)①根据平衡状态的特征解答;
②根据A点气体的体积分数结合平衡常数的概念计算;
③根据温度对平衡状态的影响分析解答。
详解:(1)Na2MoO4·2H20中Na是+1价,O是-2价,所以根据正负价代数和为0可知Mo的化合价是+6价;反应中Mo元素化合价从+4价升高到+6价,S从-2价升高到+6价,氯元素化合价从+1价降低到-1价,所以根据电子得失守恒、原子守恒和电荷守恒可知该反应的离子方程式为MoS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O。
(2)①2Mo(s)+3O2(g)=2MoO3(s)△H1
②2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g)△H2
③MoS2(s)+2O2(g)=Mo(s)+2SO2(g)△H3
根据盖斯定律可知(②-①)/2得到MoS2(s)+2O2(g)=Mo(s)+2SO2(g)△H3=![]() 。
。
(3)①A.2v正(H2)=v逆(CO)不满足反应速率之比是化学计量数之比,反应没有达到平衡状态,A错误;
B.CO体积分数保持不变说明正逆反应速率相等,反应达到平衡状态,B正确;
C.反应前后混合气体的质量和物质的量是变化的,因此混合气体的平均相对分子质量不再变化说明正逆反应速率相等,反应达到平衡状态,C正确;
D.对于具体的化学反应,△H是不变的,D错误。答案选BC。
②图1中A点氢气和水蒸气的体积分数相等,均是40%,所以CO的体积分数是20%,这说明氢气、一氧化碳、水蒸气的物质的量之比是2:1:2,所以对应的平衡常数Kp=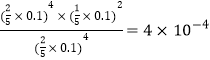 ;
;
③升高温度氢气的体积分数减小,说明平衡向正反应方向进行,正反应是吸热反应,所以升高温度正反应的平衡常数增大,则逆反应的平衡常数减小,因此表示逆反应的平衡常数(K逆)的曲线是B;T1时正逆反应速率的平衡常数相等,因此对应的平衡常数为1.0。


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】已知A为常见的金属单质,根据下图所示的关系:

(1)确定A、B、C、F的化学式,A为________,B为________,C为________,F为________。
(2)写出⑧的化学方程式,④、⑤的离子方程式。
⑧_________________________________________________。
④________________________________________________。
⑤___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于NaHCO3和Na2CO3的性质判断正确的是( )
A. 常温下溶解度:NaHCO3>Na2CO3
B. 常温下,相同物质的量浓度溶液的碱性:NaHCO3>Na2CO3
C. 与同浓度、同体积的盐酸反应生成气体的快慢:NaHCO3<Na2CO3
D. 热稳定性:NaHCO3<Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏德罗常数的数值,下列叙述正确的是
A. 标准状况下,22.4LCCl4含有分子数为1 NA
B. 常温常压下,1.42g Na2SO4含的有的Na+离子数为0.01 NA
C. 标准状况下,1.5 NA 个CO2分子占有的体积约为33.6L
D. 物质的量浓度为1mol/L的MgCl2溶液中,含有Cl- 个数为2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用某废镍催化剂(含NiCO3、Na2SiO3,少量Fe3O4、Cr2O3)制备NiSO4,流程如下:

![]()
(1)“酸溶”后,加入十六烷基三甲基氯化铵溶液出现大量白色沉淀,写出“酸溶”时生成硅酸的离子方程式:_________________。
(2)“碱析”时,常温下调pH=____时Fe3+恰好沉淀完全;工业上把pH调至10,此时沉淀物有Fe(OH)3和____,目的是_________。
(3)取300mL“除硅酸”后的溶液,加入双氧水受热th,得到关于沉淀率的关系图如下。

①合适的工艺条件为____________;
②温度不能太高的原因是____。
(4)“一次沉镍”产物为NiS,稀硝酸与之反应的化学反应方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.6.02×1022个H3PO4分子的质量为9.8g
B.1molH2SO4的物质的量是98g/mol
C.0.5mol的氧
D.H3PO4的摩尔质量为98
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含Fe3+、Fe2+、Al3+、Na+的溶液中加入过量Na2O2,充分反应后再加入过量的盐酸,溶液中离子数目变化最小的是( )
A.Na+B.Fe2+C.Fe3+D.Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中要使AlCl3溶液中的Al3+和NaAlO2溶液中的AlO2-全部沉淀出来,最适宜的试剂分别是( )
A.NaOH溶液,盐酸B.Ba(OH)2溶液,醋酸
C.盐酸,氨水D.氨水,CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com