
| A. | 冬季烧煤炭供热取暖与雾霾的形成无必然联系 | |
| B. | 食品包装袋中充人氮气可防腐 | |
| C. | 钢铁表面镀锌可防止铁的腐蚀 | |
| D. | 回收地沟油制造生物柴油符合环境保护的要求 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小:Z>X>Y | |
| B. | Z的氢化物的沸点一定比X 的低 | |
| C. | W的最高价氧化物对应水化物的酸性在同主族中最强 | |
| D. | Y的单质与Z、X形成的化合物反应可冶炼金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
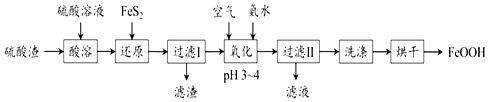
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 步骤I中白色沉淀A的化学式为BaSO4 | |
| B. | 步骤Ⅱ中产生沉淀C的反应:Fe3++3OH-=Fe(OH)3↓ | |
| C. | 原溶液一定含有:Na+、Fe2+、Al3+、SO42- | |
| D. | CO2先后分别与NaOH(aq)、NaAlO2( aq)反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
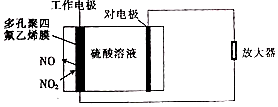 环境监察局常用“定电位”NOx传感器来监测化工厂的氮氧化物气体是否达到排放标准,其工作原理如图所示.下列说法不正确的是( )
环境监察局常用“定电位”NOx传感器来监测化工厂的氮氧化物气体是否达到排放标准,其工作原理如图所示.下列说法不正确的是( )| A. | “对电极”是负极 | |
| B. | “工作电极”上发生的电极反应为NO2+2e-+2H+═NO+H2O | |
| C. | 传感器工作时H+由工作电极移向对电极 | |
| D. | 对电极的材料可能为活泼金属锌 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |||
| n(X) | n(Y) | n(M) | n(N) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0 | 0 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0 | 0 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | 0.25 | 0.25 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 元素代号 | A | B | C | D | E | F | G |
| 原子半径/nm | 0.182 | 0.160 | 0.089 | 0.143 | 0.102 | 0.099 | 0.071 |
| 主要化合价 | +1 | +2 | +2 | +3 | +6.-2 | -1 | -1 |
| A. | 气态氢化物的稳定性HG>HF>H2E | |
| B. | B2+、D3+、E2-、G-四种离子的核外电子排布相同 | |
| C. | A、E元素与氧元素可以形成三种常见的含氧酸盐 | |
| D. | C元素的原子最外层电子数等于电子层数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com