
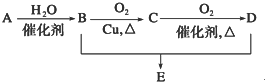
 有机物A的分子式为C2H4,可能发生以下系列转化:
有机物A的分子式为C2H4,可能发生以下系列转化:分析 有机物A分子式为C2H4,则A为CH2═CH2,A与水发生加成反应生成B为CH3CH2OH,B发生催化氧化生成C为CH3CHO,C进一步氧化生成D为CH3COOH,乙酸与乙醇发生酯化反应生成E为CH3COOCH2CH3,据此解答.
解答 解:有机物A分子式为C2H4,则A为CH2═CH2,A与水发生加成反应生成B为CH3CH2OH,B发生催化氧化生成C为CH3CHO,C进一步氧化生成D为CH3COOH,乙酸与乙醇发生酯化反应生成E为CH3COOCH2CH3,
(1)B为CH3CH2OH,含有的官能团为羟基,D为CH3COOH,含官能团为-COOH,故答案为:羟基;-COOH;
(2)A为CH2═CH2,A与水发生加成反应生成B为CH3CH2OH,化学方程式为CH2═CH2+H2O$→_{加热、加压}^{催化剂}$CH3CH2OH,
故答案为:CH2═CH2+H2O$→_{加热、加压}^{催化剂}$CH3CH2OH;加成反应;
(3)乙酸与乙醇发生酯化反应生成E为CH3COOCH2CH3,化学方程式为CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,酯化反应可逆,反应物不能完全转化为乙酸乙酯,故答案为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;不能;酯化反应可逆,反应物不能完全转化为乙酸乙酯.
点评 本题考查有机物推断,涉及烯烃、醇、醛、羧酸、酯的性质等,比较基础,有利于基础知识的巩固,注意酯化反应是可逆反应.


科目:高中化学 来源: 题型:解答题
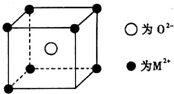 已知MO与CsCl的结构相似(如图2所示),MO晶体的密度为p g•cm-3,NA为阿伏加德罗常数,相邻的两个M2+的核间距为acm.写出Cs基态原子的价电子排布式6s1,MO的相对分子质量可以表示为ρa3 NA.
已知MO与CsCl的结构相似(如图2所示),MO晶体的密度为p g•cm-3,NA为阿伏加德罗常数,相邻的两个M2+的核间距为acm.写出Cs基态原子的价电子排布式6s1,MO的相对分子质量可以表示为ρa3 NA.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
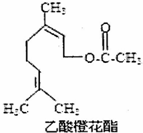
| A. | 该有机物分子式为C12H20O2 | |
| B. | 能发生加成反应和取代反应 | |
| C. | 不能使酸性KMnO4溶液褪色 | |
| D. | 1mol该有机物最多能与2mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,天然硼元素有两种稳定同位素10B、11B,其相对原子质量分别为10和11,它们的相对丰度分别为20%和80%,硼元素的平均相对质量为10.8.
,天然硼元素有两种稳定同位素10B、11B,其相对原子质量分别为10和11,它们的相对丰度分别为20%和80%,硼元素的平均相对质量为10.8.| 温度/℃ | 0 | 20 | 40 | 60 | 80 |
| 溶解度/g | 2.7 | 5.0 | 8.7 | 14.8 | 23.8 |
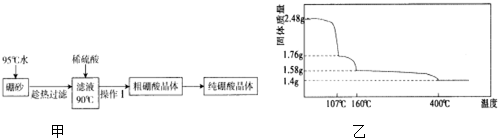
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
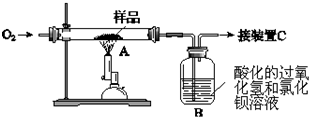
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
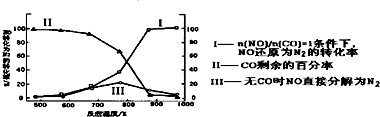
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤⑦ | B. | ②④⑥⑦ | C. | ①⑤⑥⑦ | D. | ②④⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “雨后彩虹”是一种与光学和胶体性质相关的自然现象 | |
| B. | 纯银器表面在空气渐渐变暗,是电化学腐蚀所致 | |
| C. | 右图电流表指针偏转,有电流通过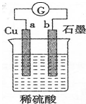 | |
| D. | 在食品中科学使用食品添加剂对人体无害 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com