
| A、取少量硫酸亚铁铵晶体放入试管中,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水 |
| B、取少量硫酸亚铁铵晶体放入试管,加浓NaOH溶液,加热,试管口湿润的蓝色石蕊试纸变红,则可证明晶体的成分中含有NH4+ |
| C、取适量硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42- |
| D、取适量硫酸亚铁铵晶体溶于水,得浅绿色溶液,滴入2滴KSCN溶液,溶液不显血红色,再滴入几滴新制氯水,溶液变为血红色,则可证明晶体的成分中含有Fe2+ |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| C(H+) |
| C(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 叙述 | 离子方程式 | 评价 |
| A | NaHCO3溶液中滴加少量的Ba(OH)2溶液 | Ba2++OH-+HCO3-=BaCO3↓+H2O | 正确 |
| B | 向NaOH溶液中滴加过量Ca(HCO3)2溶液 | OH-+HCO3-+Ca2+=CaCO3↓+H2O | 错误,Ca(HCO3)2溶液中阴阳离子比2:1 |
| C | 足量的Ba(HCO3)2溶液与NaHSO4溶液混合 | H++SO42-+Ba2++HCO3-=BaSO4↓+CO2↑+H2O | 正确 |
| D | 向KHSO4溶液中滴加Ba(OH)2溶液至溶液呈中性 | Ba2++OH-+SO42-+H+=BaSO4↓+H2O | 正确 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用托盘天平称取3.23 g NaCl固体 |
| B、称量NaOH固体时,应将砝码放在托盘天平右盘纸片上,NaOH固体放在左盘的纸片上 |
| C、用100 mL容量瓶配制50mL0.1 mol/L的盐酸 |
| D、稀释浓硫酸时,把浓硫酸沿器壁慢慢注入水中,并不断搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| 温度(℃) | 30 | 40 | 50 | 60 | 70 |
| 显色时间(s) | 160 | 80 | 40 | 20 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
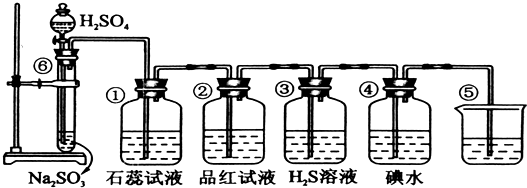
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com