
| A. | 判断该反应达到平衡的依据是CO、H2O、CO2、H2的浓度都相等 | |
| B. | 反应放出的热量为0.04 a kJ | |
| C. | 平衡时H2O的转化率为40% | |
| D. | 若将容器的体积压缩为1 L,有利于该反应平衡正向移动 |
分析 设达到平衡时,CO转化xmol,利用三段式法计算,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始:0.2mol 0.2mol 0 0
转化:xmol xmol xmol xmol
平衡:(0.2-x)mol(0.2-x)mol xmol xmol
根据在同一容器中浓度之比等于物质的量之比,c(CO):c(CO2)=3:2,
则有(0.2-x):x=3:2,
x=0.08mol,以此解答该题.
解答 解:设达到平衡时,CO转化xmol,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始:0.2mol 0.2mol 0 0
转化:xmol xmol xmol xmol
平衡:(0.2-x)mol(0.2-x)mol xmol xmol
根据在同一容器中浓度之比等于物质的量之比,c(CO):c(CO2)=3:2,
则有(0.2-x):x=3:2,
x=0.08mol,
A.达到平衡时,各物质的浓度不再改变,而浓度不一定相等,故A错误;
B.根据反应CO(g)+H2O(g)?CO2(g)+H2(g);△H=-a kJ•mol-1(a>0),可知消耗0.08mol一氧化碳放出的热量为0.08akJ,故B错误;
C.达到平衡消耗的水的物质的量为0.08mol,平衡时H2O的转化率为:$\frac{0.08mol}{0.2mol}$×100%=40%,故C正确;
D.反应前后气体的体积不变,压强对平衡移动无影响,若将容器的体积压缩为1 L,平衡不移动,故D错误.
故选C.
点评 本题考查化学平衡的计算,为高频考点,题目难度中等,解答本题的关键是根据浓度关系计算平衡时各物质的物质的量,注意利用三段式法计算较为直观,本题有利于调动学生的学习兴趣和学习积极性,能够提高学生灵活应用所学知识的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 实验编号 | 反应条件 | 时间 | NO/mol | Cl2/mol | NOCl/mol |
| 实验① | T、恒容 | 初始 | 0.2 | 0.1 | 0 |
| 10 min | 0.05 | 0.025 | |||
| 12 min | 0.15 | ||||
| 实验② | T、恒压 | 初始 | 0.2 | 0.1 | 0 |
| A. | 实验①中,0~10min内,v(NOCl)=7.5×10-3 mol•L-1•min-1 | |
| B. | 平衡时若升高温度,达到新平衡时K=400,则该反应△H>0 | |
| C. | 平衡时实验②比实验①的Cl2转化率大 | |
| D. | 若实验①起始只充入0.4molNOCl,则平衡时NOCl浓度大于0.15mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 1.0MPa | 2.0MPa | 3.0MPa | |
| 810℃ | 54.0% | a | b |
| 915℃ | c | 75.0% | d |
| 1000℃ | e | f | 83.0% |
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡时c(NH3)=5mol/L | |
| B. | 平衡时HI分解率为20% | |
| C. | 混合气体的平均摩尔质量不再发生变化不可以作为判断该反应达到平衡状态的标志 | |
| D. | 平衡后缩小容器体积,NH4I的物质的量增加,I2的物质的量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/s | 20 | 40 | 60 | 80 | 100 |
| c(NO2 )/(mol/L) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
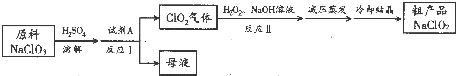
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干燥的氯气可以贮存在钢瓶中 | |
| B. | 氯气是一种黄绿色的,强烈刺激性气味的有毒气体 | |
| C. | 工业上常用电解熔融氯化钠的方法制备氯气 | |
| D. | 氯气能给水进行消毒是因为氯气与水反应生成了HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.35mol/L | B. | 0.45mol/L | C. | 0.5mol/L | D. | 0.6mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com