
 室温下,单质A、B、C分别为铁、黄绿色气体、无色气体,在合适的反应条件下,它们可以按如图所示进行反应.又知E的水溶液是无色的.
室温下,单质A、B、C分别为铁、黄绿色气体、无色气体,在合适的反应条件下,它们可以按如图所示进行反应.又知E的水溶液是无色的.
| ||
| ||


科目:高中化学 来源: 题型:
| A、(A-x+n)mol | ||
| B、(A-x-n)mol | ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.09mol |
| B、0.10mol |
| C、0.11mol |
| D、0.12mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
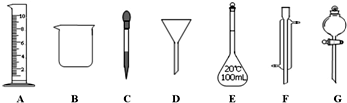
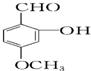
查看答案和解析>>
科目:高中化学 来源: 题型:
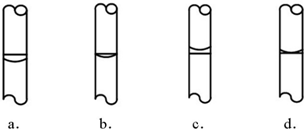
 b.
b.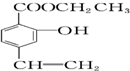 c.
c.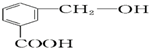
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com