
C、N、O是中学化学常见的三种元素,请回答下列问题:
(1)写出基态O2-的核外电子排布式______________________________。
(2)C、N、O三种元素的第一电离能由大到小的顺序为_____________________________。
(3)光气( )分子中含有______个
)分子中含有______个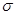 键,____个
键,____个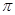 键,其中C原子的杂化方式为_______。
键,其中C原子的杂化方式为_______。
(4)水的熔点比H2S的熔点高,其原因是________________。
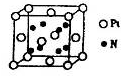
(5)超硬材料氮化销的晶胞如图 所示,则氮化铂的化学式为_______。
所示,则氮化铂的化学式为_______。
(除注明外,每空1分,共8分)(1)1s22s22p6 (2)3;1;sp2
(4)H2O分子间形成氢键 (5)PtN2
【解析】
试题分析:(1)O2-核外有10个电子,根据构造原理可知,其核外电子排布式为1s22s22p6。
(2)同周期第一电离能自左而右具有增大趋势,所以第一电离能O>C。由于氮元素原子2p能级有3个电子,处于半满稳定状态,能量较低,第一电离能大于相邻元素,所以B、C、D三种元素的第一电离能数值由大到小的顺序为N<O<C。
(3)单键都是σ 键,双键是由一个σ 键和1个π键构成的。所以根据光气的结构式可知,光气分子中含有3σ键,一个π键,碳原子含有3个σ 键且不含孤电子对,所以其杂化方式为sp2。
(4)O、S属于同一主族元素,硫化氢的相对分子质量大于水,但水中含有氢键,导致水的熔点比H2S的熔点高。
(5)根据晶胞结构并依据均摊法可知,N原子个数=8个,Pt原子个数=8×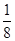 +6×
+6×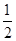 =4个,所以其化学式为PtN2。
=4个,所以其化学式为PtN2。
考点:考查核外电子排布、第一电离能、共价键、杂化轨道类型、氢化物沸点比较、晶体结构化学式计算


科目:高中化学 来源: 题型:
 [化学选修3:物质结构与性质]
[化学选修3:物质结构与性质]查看答案和解析>>
科目:高中化学 来源: 题型:
 (2013?枣庄二模)C、N、O是中学化学常见的三种元素,请回答下列问题:
(2013?枣庄二模)C、N、O是中学化学常见的三种元素,请回答下列问题: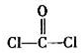 )分子中含有
)分子中含有查看答案和解析>>
科目:高中化学 来源: 题型:

 Fe3O4+4H2
Fe3O4+4H2 Fe3O4+4H2
Fe3O4+4H2| c4(H2) |
| c4(H2O) |
| c4(H2) |
| c4(H2O) |

查看答案和解析>>
科目:高中化学 来源: 题型:
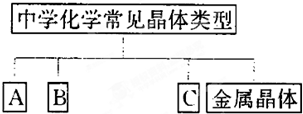
| A | B | C | ||
| 晶体类别 | 金属晶体 | |||
| 实例的化学式 | Na |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com