

分析 (1)①实验室用二氧化锰和浓盐酸在加热条件下制取氯气;氯气有强氧化性,能氧化还原性的微粒,根据溶液中颜色的变化判断微粒氧化性的强弱;
②氯气和氨气反应生成氯化氢和氮气,氯化氢和氨气相遇生成白色烟氯化铵,氯气的颜色消失;发生一系列的反应后烧杯内的气体压强变小,形成喷泉;
(2)①亚硫酸根离子生成硫酸根离子需要氧化剂,所选试剂应具有氧化性.
②氯气有氧化性,亚硫酸根离子有还原性,所以亚硫酸根离子和氯气能发生氧化还原反应.
解答 解:(1)①实验室用二氧化锰和浓盐酸在加热条件下制取氯气,反应离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;在G装置中,应用一个方程式判断出Cl2、Fe3+、I2的氧化性强弱,根据氧化剂的氧化性大于氧化产物的氧化性,氯气有氧化性,要检验微粒的氧化性,应该选择还原性的物质,所以M是FeI2;氯气先和碘离子反应生成碘单质,四氯化碳能萃取碘,所以下层由无色变成紫红色,碘离子完全被氧化后,氯气再和亚铁离子反应生成铁离子,使上层溶液由亚铁离子颜色变成铁离子颜色,即由浅绿色变成黄色,由此证明氧化性Cl2>Fe3+>I2,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;FeI2;先观察到下层CCl4由无色变为紫红色,后看到上层溶液由浅绿色变为黄色;
②氯气和氨气反应生成氯化氢和氮气,氯化氢和氨气相遇立即反应生成白烟氯化铵,所以看到的现象是黄绿色气体消失,产生白烟;反应一段时间后,关闭b打开c,烧瓶内气体压强小于空气压强导致烧杯中的液体进入烧瓶中,形成喷泉,
故答案为:黄绿色气体消失,产生白烟,烧杯中的液体进入烧瓶中,形成喷泉;
(2)①亚硫酸根离子有还原性,能被强氧化剂氧化成硫酸根离子,所以要想使亚硫酸根离子生成硫酸根离子,应选择氧化性物质.
A.虽然酸性高锰酸钾有强氧化性,但有硫酸根离子造成干扰,故A错误;
B.氢氧化钠没有氧化性,故B错误;
C.氯水有强氧化性,且不造成干扰,故C正确;
D.碘化钾有还原性没有氧化性,故D错误;
故答案为:C;
②氯气有氧化性,亚硫酸根离子有还原性,所以亚硫酸根离子和氯气能发生氧化还原反应生成氯离子、硫酸根离子和氢离子,离子方程式为:Cl2+SO32-+H2O=2Cl-+SO42-+2H+,
故答案为:Cl2+SO32-+H2O=2Cl-+SO42-+2H+.
点评 本题考查了氯气的实验室制法、氯气的性质、氧化性和还原性的比较等知识点,明确实验原理、氧化还原反应规律是解题关键,题目难度中等,侧重于考查学生对基础知识的应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.
中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | w=$\frac{36.5a}{(36.5a+22400)}$ | B. | w=$\frac{36.5c}{1000b}$ | ||
| C. | C=$\frac{1000ab}{(36.5a+22400)}$ | D. | b=$\frac{(36.5a+22400)}{(a+1)}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
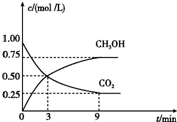
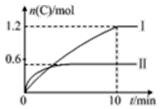 在2L的恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1,实验内容和结果分别如表和图所示,下列说法正确的是( )
在2L的恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1,实验内容和结果分别如表和图所示,下列说法正确的是( )| 实验 序号 | 温度 | 起始物质的量 | 热量 变化 | |
| A | B | |||
| Ⅰ | 600℃ | 1 mol | 3 mol | 96 kJ |
| Ⅱ | 800℃ | 1.5 mol | 0.5 mol | -- |
| A. | 上述方程式中a=-160 | |
| B. | 实验Ⅰ中,10 min内平均速率v(B)=0.06 mol•L-1•min-1 | |
| C. | 600℃时,该反应的平衡常数是0.45 | |
| D. | 向实验Ⅱ的平衡体系中再充入0.5 mol A和1.5 mol B,A的转化率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
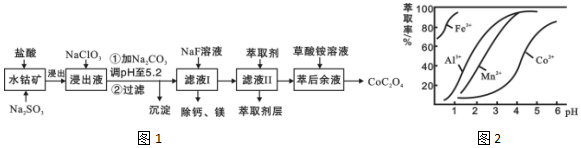
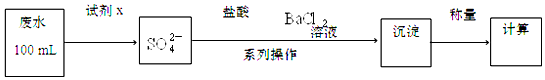
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com