
| A、1molN2所含有的原子数为NA |
| B、标准状况下,22.4L水中含有的水分子数为NA |
| C、标准状况下,22.4L氯化氢所含的原子数为NA |
| D、24gO2分子和24gO3分子所含的氧原子数目相等 |


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
| A、过氧化钠是淡黄色固体,可用于呼吸面具中作为氧气的来源 |
| B、氧化钠和过氧化钠都能与二氧化碳反应,生成物完全相同 |
| C、碳酸钠固体中混有少量碳酸氢钠,可用加热的方法除去 |
| D、质量相等的碳酸钠和碳酸氢钠分别与足量盐酸反应,后者产生气体多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、固体的溶解过程只与焓变有关 |
| B、反应焓变是决定反应能否自发进行的唯一因素 |
| C、温度、压强一定时,焓因素和熵因素共同决定一个化学反应的方向 |
| D、某一化学反应的△H>0和△S>0,则该反应一定自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化还原反应必然有氧元素的得失 |
| B、置换反应一定属于氧化还原反应 |
| C、某元素在化学反应中由化合态变为游离态,该元素可能被氧化,也可能被还原 |
| D、失电子越多还原性越强,得电子越多氧化性越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、50mL2mol/LCaCl2溶液 |
| B、100mL2moL/LNaCl溶液 |
| C、50mL4mol/LCaCl2溶液 |
| D、100mL4mol/LNaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下2.24LCO2通入1mol?L-1100mL氢氧化钠溶液中:CO2+OH-=HCO3- |
| B、硝酸铝溶液中加入过量氨水:Al3-+4NH3?H2O=AlO2-+4 NH4++2H2O |
| C、Na2S水解:S2-+2 H2O?H2S+2OH- |
| D、等物质的量的NH4HCO3与NaOH在溶液中反应:NH4++HCO3-+2OH-=CO32-+NH3↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过氧化钠与水反应2O22-+2H2O=4OH-+O2↑ |
| B、铝与氢氧化钠溶液反应Al+OH-+H2O=AlO2-+H2↑ |
| C、硫酸铝和氨水反应Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| D、氯气与氢氧化钠溶液反应Cl2+2OH-=Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
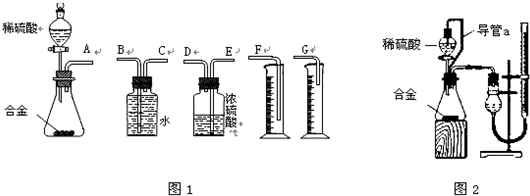
查看答案和解析>>
科目:高中化学 来源: 题型:
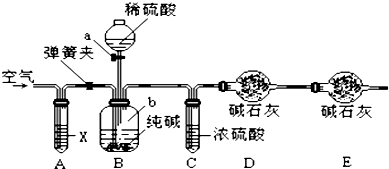
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com