
| A. | 具有规则几何外形的固体均为晶体 | |
| B. | 晶体具有自范性,有固定的熔点,可以使X光发生有规律的衍射 | |
| C. | 晶体研碎后即变为非晶体 | |
| D. | 将玻璃加工成规则的固体即变成晶体 |
分析 晶体由固定的熔点,非晶体没有固定的熔点,同时晶体内部排列有规则,而非晶体则没有,但形状不一定有规则,晶体分为单晶体和多晶体:其中单晶体具有各向异性,多晶体和非晶体一样具有各向同性,晶体具有自范性,而非晶体没有自范性.
解答 解:A.具有规则几何外形的固体不一定是晶体,故A错误;
B、晶体与非晶体最本质的区别是组成物质的粒子在微观空间是否有序排列,x射线衍射可以看到微观结构,即晶体具有自范性,有固定的熔点,可以使X光发生有规律的衍射,故B正确;
C.晶体研碎后还是晶体,故B错误;
D.将玻璃加工成规则的固体,玻璃仍然不是晶体,属于玻璃态物质,故D错误;
故选B.
点评 本题考查了晶体和非晶体的判断,根据其特点来分析即可,难度不大.


科目:高中化学 来源: 题型:选择题
| 化学方程式 | 结论 | |
| A | 4Cu0$\frac{\underline{\;高温\;}}{\;}$2Cu2O+O2↑ | 热稳定性:Cu2O>CuO |
| B | 2KClO3+I2$\frac{\underline{\;\;△\;\;}}{\;}$2KIO3+Cl2 | 非金属性:I>Cl |
| C | H2S+CuSO4═CuS↓+H2SO4 | 酸性:H2S>H2SO4 |
| D | CH3COOCH2CH3+H2O?CH3COOH+CH3CH2OH | 反应类型:既是水解反应,也是加成反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥⑦ | B. | ①②③⑥ | C. | ①②⑥ | D. | ①②③⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯中C=C的键能是乙烷中C-C的键能的2倍 | |
| B. | 同一原子中,2p,3p,4p能级的轨道数目依次增多 | |
| C. | C-O键的极性比N-O键的极性大 | |
| D. | 根据能量最低原理,原子的核外电子排布先填满离核近的轨道,再填充离核远的轨道 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
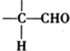
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 $\stackrel{稀氢氧化钠溶液}{→}$
$\stackrel{稀氢氧化钠溶液}{→}$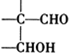 -CHO+
-CHO+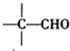 +NaOH(浓)→
+NaOH(浓)→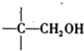 +
+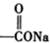
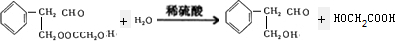
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
 或
或 ;由②、④两种元素形成的一种气体会产生温室效应,其电子式为:
;由②、④两种元素形成的一种气体会产生温室效应,其电子式为: .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com