

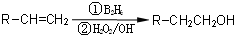
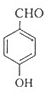
 ,逆推可知G为
,逆推可知G为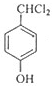 ,F为
,F为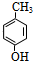 ,据此解答.
,据此解答. ,逆推可知G为
,逆推可知G为 ,F为
,F为 ,
, ,故答案为:
,故答案为: ;
; ,E与H反应生成I的方程式为:
,E与H反应生成I的方程式为: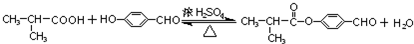 ,
, ;
; ;
;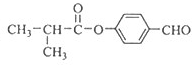 )的同系物K比I相对分子质量小28,则K比I少2个-CH2-原子团,K的结构中能同时满足如下条件:①苯环上只有两个取代基;②分子中不含甲基,侧链为-CHO、-CH2OOCH,或-CH2CHO、-OOCH,或-CHO、-CH2COOH,或-CH2CHO、-COOH,各有邻、间、对三种位置,故有12种,上述同分异构体中任意一种消耗NaOH最多的有机物结构简式为:
)的同系物K比I相对分子质量小28,则K比I少2个-CH2-原子团,K的结构中能同时满足如下条件:①苯环上只有两个取代基;②分子中不含甲基,侧链为-CHO、-CH2OOCH,或-CH2CHO、-OOCH,或-CHO、-CH2COOH,或-CH2CHO、-COOH,各有邻、间、对三种位置,故有12种,上述同分异构体中任意一种消耗NaOH最多的有机物结构简式为: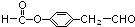 等,
等,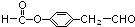 等.
等.


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
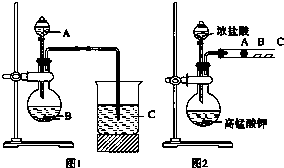 某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律.图2中,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律.图2中,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.4 mol |
| B、小于0.2 mol |
| C、0.2 mol |
| D、大于0.2 m01而小于0.4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com