
【题目】下表是元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答下列问题。
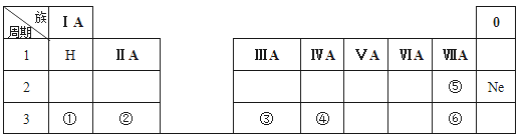
(1)元素④的符号是_______;②的最高价氧化物对应水化物的化学式为_______;⑤和⑥两种元素原子半径的大小关系:⑤_____⑥(填“>”或“<”);
(2)①和②两种元素金属性强弱关系:①_____②(填“>”或“<”);
(3)①的最高价氧化物的水化物与元素③的单质反应的化学方程式为:___________。
【答案】Si Mg(OH)2 < > 2NaOH+2Al+2H2O=2NaAlO2+3H2↑
【解析】
根据元素在周期表中的相对位置首先判断出元素,然后结合元素周期律以及有关物质的性质分析解答。
由元素在周期表中位置可知,①为Na、②为Mg、③为Al、④为Si、⑤为F、⑥为Cl,则
(1)元素④是硅,元素符号是Si;②是Mg,最高价氧化物对应水化物的化学式为Mg(OH)2;同主族随原子序数增大,原子半径逐渐增大,故原子半径F<Cl;
(2)①为Na、②为Mg,二者处于同一周期,原子序数越大,金属性越弱,则金属性大小为:Na>Mg;
(3)①的最高价氧化物的水化物为NaOH,元素③的单质为Al,Al与NaOH溶液反应生成偏铝酸钠和氢气,反应的化学方程式为2NaOH+2Al+2H2O=2NaAlO2+3H2↑。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】同温同压下,等体积的一氧化二氮(N2O)和二氧化碳两种气体相比较:①质量相等、②所含碳原子数与氮原子数相等、③所含分子数相等。上述结论中正确的是( )
A. ①②③ B. ②③ C. ①② D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以丁烯二醛和肼为原料经过DielsAlder反应合成哒嗪,合成关系如图:
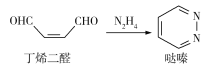
下列说法正确的是
A. 哒嗪与氢气加成后的产物分子式为C4H6N2
B. 聚丁烯二醛因无碳碳双键不能使溴水褪色
C. 丁烯二醛与N2H4可以在一定条件下加成后再消去可制得哒嗪
D. 物质的量相等的丁烯二醛和哒嗪分别与氢气完全加成,消耗氢气的量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的含氧衍生物可以作为无铅汽油的抗爆震剂,它的相对分子质量不超过100,含C的质量分数为68.2%,含H的质量分数为13.6%,其余为氧。请计算回答:
(1)该化合物的相对分子质量是____________________。
(2)写出该化合物的分子式___________________________。
(3)若该化合物不能与钠反应产生氢气,红外光谱和核磁共振氢谱显示该分子中有4个甲基。请写出其结构简式。_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2FeO4是一种集氧化、吸附、絮凝、消毒、杀菌、除臭等功能于一体的绿色高效水处理剂,已成为多个领域不可短缺的物质之一,工业制备工艺如图所示,回答下列问题:

(1)在湿法制备Na2FeO4工艺中,请写出氯碱工业过程中用惰性电极电解饱和NaCl溶液的离子方程式:___;NaClO与FeCl3在碱性条件下制备Na2FeO4的反应中被氧化的原子与被还原的原子个数比为____;可循环使用的物质为___(任写一种)。
(2)电解法制备Na2FeO4工艺中,阳极材料为铁平板,在使用前要经过粗砂和细砂打磨抛光,其目的为____;钛合金材料作阴极,电解质溶液为NaOH溶液,请写出阳极电极反应式:____。
(3)干法制备Na2FeO4工艺是最早发现的制备工艺,请写出NaClO固体、Fe(NO3)3·9H2O晶体、NaOH固体在高温熔融的条件下制备Na2FeO4的化学方程式:_____。
(4)请写出由Na2FeO4制备K2FeO4的化学方程式:____;请说明该反应能发生的原因:____。
(5)粗K2FeO4提纯时用-5℃饱和KOH的原因____;K2FeO4是绿色水处理剂,能对水起到杀菌、消毒,又能起到净水的作用,其原因为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要配制1.0mol/L的氢氧化钠溶液480mL。完成下列各题。
(1)应选择规格为_______mL的容量瓶,该容量瓶上除注明规格外,还______________(选填编号)。
a.温度 b.浓度 c.压强 d.刻度线
(2)用电子天平称取_____gNaOH。
(3)将称好的氢氧化钠固体加适量蒸馏水将其溶解,待冷却后将溶液移入容量瓶中。
(4)用少量蒸馏水冲洗________________2~3次,将洗液移入容量瓶中。
(5)向容量瓶内加水至接近刻度1~2cm处,改用胶头滴管小心地加水至刻度线。
(6)最后塞好瓶塞,摇匀,将配好的溶液移入试剂瓶中并贴好标签。
(7)分析下列操作可能会对氢氧化钠溶液浓度造成的影响(填“偏高”、“偏低”或“无影响”)。
①氢氧化钠溶解后,未冷却即转移_________。
②定容时仰视___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.标况下,11.2 L甲烷(CH4)和乙烯(C2H4)的混合气体中含氢原子的物质的量为2 mol
B.标况下,0.1 mol CCl4所占的体积为2.24 L
C.等质量的N2和CO含有的分子数均约为6.02×1023个
D.常温常压下,1 mol任何气体所占的体积均为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】七铝十二钙(12CaO7Al2O3)是新型的超导材料和发光材料,用白云石(主要含CaCO3和MgCO3)和废Al片制备七铝十二钙的工艺如下:
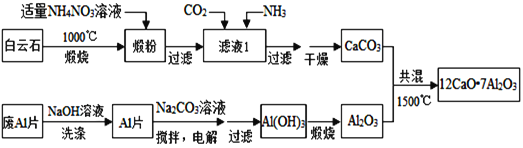
(1)锻粉主要含______和______,用适量NH4NO3溶液浸取煅粉后,镁化合物几乎不溶。该工艺中不能用(NH4)2SO4代替NH4NO3,原因是_______________________________________________.
(2)滤液Ⅰ中阴离子有______(忽略杂质成分的影响);若滤液Ⅰ中仅通入CO2,会生成______,从而导致CaCO3产率降低.
(3)用NaOH溶液可除去废Al片表面的氧化膜,反应的离子方程式为______________________.
(4)电解制备Al(OH)3时,电极分别为Al片和石墨,则铝片接外电源的____极,电解时阴极发生的反应为:______.
(5)一种可超快充电的新型铝电池,充放电时AlCl4﹣和Al2Cl7﹣两种离子在Al电极上相互转化,其它离子不参与电极反应,放电时负极Al的电极反应式为______________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定某有机物A的结构,做如下实验:
①将2.3 g该有机物完全燃烧,生成0.1 mol CO2和2.7 g水;
②用质谱仪测定其相对分子质量,得如图一所示的质谱图;
③用核磁共振仪处理该化合物,得到如图二所示图谱,图中三个峰的面积之比是1∶2∶3。试回答下列问题:
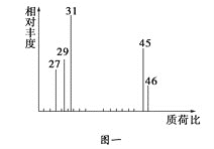
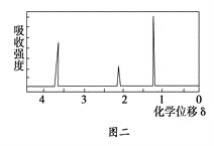
(1)有机物A的相对分子质量是________。
(2)有机物A的实验式是________。
(3)A的分子式是_______________________________________。
(4)A的结构简式为___________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com