
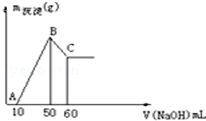
 把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1mol•L-1NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示,回答下列问题,要求写出计算过程.
把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1mol•L-1NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示,回答下列问题,要求写出计算过程.分析 ①加入氢氧化钠溶液为60mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液,根据钠元素守恒此时溶液中n(NaCl)=n(NaOH),据此计算出n(HCl),再利用c=$\frac{n}{V}$计算盐酸的物质的量浓度.
②由图可知,从加入10m氢氧化钠溶液开始产生沉淀,加入氢氧化钠溶液为50mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,该阶段消耗氢氧化钠40mL,由氢氧根守恒可知3n[Al(OH)3]+2n[Mg(OH)2]=n(NaOH)=(0.05L-0.01L)×1mol/L=0.04mol.从加入氢氧化钠溶液50mL~60mL溶解氢氧化铝,该阶段发生反应Al(OH)3+NaOH=NaAlO2+2H2O,所以n[Al(OH)3]=(0.06L-0.05L)×1mol/L=0.01mol,代入上式计算n[Mg(OH)2],由元素守恒可知n(Mg)=n[Mg(OH)2],再利用m=nM计算Mg的质量.
解答 解:①加入氢氧化钠溶液为50mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液,根据钠元素守恒此时溶液中n(NaCl)=n(NaOH)=0.05L×1mol/L=0.05mol,根据氯元素守恒n(HCl)=0.05mol,故盐酸的物质的量浓度为$\frac{0.05mol}{0.1L}$=0.5mol/L,
故答案为:0.5;
②由图可知,从加入10m氢氧化钠溶液开始产生沉淀,加入氢氧化钠溶液为50mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,该阶段消耗氢氧化钠40mL,由氢氧根守恒可知3n[Al(OH)3]+2n[Mg(OH)2]=n(NaOH)=(0.05L-0.01L)×1mol/L=0.04mol.从加入氢氧化钠溶液50mL~60mL溶解氢氧化铝,该阶段发生反应Al(OH)3+NaOH=NaAlO2+2H2O,所以n[Al(OH)3]=(0.06L-0.05L)×1mol/L=0.01mol,故3×0.01mol+2n[Mg(OH)2]=0.04mol,解得n[Mg(OH)2]=0.005mol,由元素守恒可知n(Mg)=n[Mg(OH)2]=0.005mol,故m(Mg)=0.005mol×24g•mol-1=0.12g,
故答案为:0.12.
点评 本题考查镁铝化合物性质、混合物的计算,以图象题的形式考查,题目难度中等,分析图象各阶段的发生的反应是解题关键,再利用守恒计算,侧重于考查学生的分析能力和计算能力.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲烷与乙烯共1 mol,完全燃烧后生成2mol H2O | |
| B. | 光照下,异丁烷与Cl2发生取代反应生成的一氯代物有2种 | |
| C. | 乙烯可以用作生产食品包装材料的原料 | |
| D. | 乙烷室温下能与浓盐酸发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
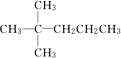 .
. 、
、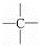 中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用N1、N2、N3、N4表示.例如:
中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用N1、N2、N3、N4表示.例如: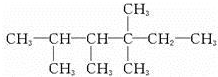
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往氯化铝溶液中滴加过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| B. | 氯气通入水中:Cl2+H2O?2H++Cl-+ClO- | |
| C. | 往澄清石灰水中通入过量CO2:CO2+OH-=HCO3- | |
| D. | 铁粉和浓盐酸反应:Fe+2H+=Fe2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸 | B. | 稀硝酸 | C. | NaOH溶液 | D. | 硫酸铜溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si→SiO2→H2SiO3→Na2SiO3 | B. | C→CO2→CaCO3→CO2→C | ||
| C. | Al→Al2O3→Al(OH)3→NaAlO2 | D. | FeCO3→FeO→Fe(OH)2→Fe(OH)3→Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH3-CH3 | B. | CH3COOH | C. | CH3COOCH3 | D. | CH3COCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com