
����β���к����ϰ��ֲ�ͬ�Ļ�������е���Ⱦ���й�������������һ����̼��������̼��̼�⻯������������Ǧ������������ȣ�һ���γ�һ���ŷŵ��к�����������������3��������NO������������ȼ��ȼ�յĸ�������N2��O2��Ӧ���£�N2(g)+O2(g) 2NO(g) ��H>0����֪�÷�Ӧ��2404��ʱ��ƽ�ⳣ��K=64��10-4����ش�
2NO(g) ��H>0����֪�÷�Ӧ��2404��ʱ��ƽ�ⳣ��K=64��10-4����ش�
(1)ij�¶��£���4L�ܱ������г���N2��O2��4mol��ƽ��ʱ��5���Ӻ�O2�����ʵ���Ϊ1mol����N2�ķ�Ӧ������____________��
(2)���������£��жϸ÷�Ӧ�ﵽƽ��ı�־��________��(����ĸ���)��
A.����1mol N2ͬʱ����1mol O2 B.��������ܶȲ���
C.�������ƽ����Է����������� D.2v(N2)����v(NO)��
(3)��N2��O2�Ļ�����������º����ܱ������У����б仯������ȷ����________(����ĸ���)��
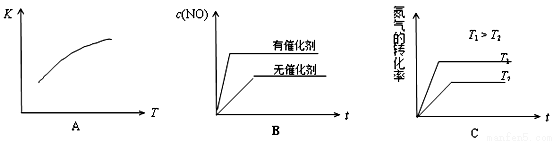
(4)���淴ӦN2(g)+O2(g) 2NO(g)��ƽ�ⳣ������ʽΪ____________���¶����ߣ�ƽ�ⳣ������
2NO(g)��ƽ�ⳣ������ʽΪ____________���¶����ߣ�ƽ�ⳣ������
_____________(�������)
(5)���¶��£�ijʱ�̲��������N2��O2��NO��Ũ�ȷֱ�Ϊ2.5��10-1mol��L-1��4.0��10-2mol��L-1��3.0��10-3mol��L-1����ʱ��Ӧ___________(����ڻ�ѧƽ��״̬������������Ӧ������С������淴Ӧ������С�)��
(6) ���ȼ��N2H4(��)��NO2��ȼ�գ�����N2��Һ̬ˮ����֪��
N2(g)+2O2(g)��2NO2(g) ��H1��+67kJ/mol
N2H4(g)+O2(g)��N2(g)+2H2O(l) ��H2��-534kJ/mol
�ɴ���д��������ʱȼ�շ�Ӧ���Ȼ�ѧ����ʽ____________________��
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ�����и߶���ѧ����ѧ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
������ijѧ���������ݷ����������������ȷ���ǣ� ��
A. �����������Է��������������ԱȽ���ͬ״���������ܶȵĴ�С
B. ���ݼ����������۵㣬���ܱȽ϶��߾����еķ��Ӽ��������Ĵ�С
C. �Ƚ�ͬ�������Ԫ��ԭ�Ӱ뾶�Ĵ�С�������ƶ�Ԫ�صĽ�����ǿ��
D. ����Һ���ܶȵĴ�С�������ж�Һ��Ļӷ��Ե�ǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ������ʡ��«���и�һ��ѧ��ѡ�ο��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ij��ɫ����������Һ�У��ܹ�����������ǣ�������
A. NH4+��NO3����Al3+��Cl�� B. Na+��AlO2����K+��NO3��
C. MnO4����K+��SO42����Na+ D. K+��SO42����HCO3����Na+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�콭��ʡ������ѧ���ڳ����Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���й��ڸ�ͼ��������ȷ����

A. ͼ�ױ�ʾH2��O2������Ӧ�����е������仯����H2��ȼ����Ϊ241.8 kJ•mol-1
B. ͼ�ұ�ʾһ�������½��еķ�Ӧ2SO2+O2 2SO3���ɷֵ����ʵ����仯��t2ʱ�̸ı������һ������С�������
2SO3���ɷֵ����ʵ����仯��t2ʱ�̸ı������һ������С�������
C. ͼ����ʾA��B�����ʵ��ܽ�����¶ȱ仯�������t1��ʱA��B�ı�����Һ�ֱ�������t2��ʱ�����ʵ�����������(B)>��(A)
D. ͼ����ʾ�����£�ϡ��HA��HB�������ϡ��Һʱ����ҺpH���ˮ���ı仯����NaA��Һ��pHС��ͬŨ�ȵ�NaB��Һ��pH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�콭��ʡ������ѧ���ڳ����Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����й��������ʼ���Ӧ�õ�˵������ȷ����
A. ̼������Һ�ʼ��ԣ������ȵĴ�����Һ��ȥ����������
B. ���������۵�ܸߣ��������������²���
C. Cl2��SO2����Ư���ԣ���ʹ��ɫʯ����Һ��ɫ
D. �ƵĽ�����ǿ�ڼأ���ҵ�Ͽ�������ȡ��Na+KCl K��+NaCl
K��+NaCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�����и߶���ѧ�ڿ�ѧ�������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����л�������ʣ�����˵������ȷ����
A. CH4��������Cl2�ڹ��������·���ȡ����Ӧ����CCl4
B. CH2=CH2��ʹ���Ը��������Һ��ɫ����Ϊ������������Ӧ
C. ͨ������£�������ɫ���壬���ڴ�����������Br2������ȡ����Ӧ
D. �Ҵ�����������������Ӧ�������������ǿ��淴Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ���Ĵ�ʡ�߶���ѧ�ڿ�ѧ���Ի�ѧ�Ծ��������棩 ���ͣ�ʵ����
ijʵ��С����0.50 mol/L NaOH��Һ��0.50 mol/L������Һ�����к��ȵIJⶨ��
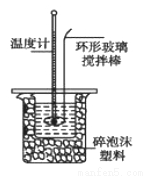
������0.50 mol/L NaOH��Һ
��ʵ���д�ԼҪʹ��245 mL NaOH��Һ��������Ҫ����NaOH����_____g��
�ⶨϡ�����ϡ���������к��ȵ�ʵ��װ����ͼ��ʾ��
��1��д���÷�Ӧ���Ȼ�ѧ����ʽ���к���Ϊ57.3 kJ/mol����_____________��
��2��ȡ50 mL NaOH��Һ��30 mL������Һ����ʵ�飬ʵ���������±���
������д�±��еĿհף�
��ʼ�¶�t1/�� | ��ֹ�¶� t2/�� | �¶Ȳ�ƽ��ֵ ��t2-t1��/�� | |||
H2SO4 | NaOH | ƽ��ֵ | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ______ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
�ڽ�����Ϊ0.50 mol/L NaOH��Һ��0.50 mol/L������Һ���ܶȶ���1 g/cm3���кͺ�������Һ�ı�����c=4.18 J/(g�����������к��ȡ�H=______________ȡС�����һλ����
������ʵ����ֵ�����57.3 kJ/mol��ƫ�����ƫ���ԭ������ǣ�______��
A��ʵ��װ�ñ��¡�����Ч����
B����ȡNaOH��Һ�����ʱ���Ӷ���
C���ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ���
D�����¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�ӲⶨH2SO4��Һ���¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ӱ�ʡ������ѧ�ڿ�ѧ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��02 mol KMnO4��һ���¶��¼��Ⱥ�����a mol O2����ʣ����������Ũ�����ϼ���������b mol Cl2����ʱ��Ԫ�ؾ���Mn2+��ʽ���ڡ���a+b=m����m��ֵ����Ϊ
A. 030 B. 035 C. 040 D. 050
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ���½����ŵڶ�ʦ��ɽ��ѧ�߶���ѧ��ѧǰ���Ի�ѧ�Ծ��������棩 ���ͣ������
������һ�ֳ��������ᣬ�ش��������⣺
��0.1mol��L��1�����м����������ʣ�����ĵ���ƽ�⼰ƽ��ʱ���ʵ�Ũ�ȵı仯��
��1��������м�������ƹ��壬����ƽ����___________�ƶ���������������ƶ�������ͬ����pH __________�����������С�����䡱����ͬ��
��2��������м���̼��ƹ��壬����ƽ����________�ƶ���c��CH3COOH��_________��
��3��������м��������ˮ��c��OH����_________����������__________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com