
用稀硫酸、氨水、氢氧化钠溶液中的任何一种作为试剂,均可鉴别的一组物质是
A.NaCl和Na2CO3
B.BaCl2和FeCl2
C.FeCl2和FeSO4
D.Al2(SO4)3和AlCl3
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 温度(℃) | 60 | 240 | 930 | 1000 |
| 残留固体质量(g) | 19.7 | 16.1 | 8.1 | 8.1 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2015届重庆市高二上学期期中考试化学试卷(解析版) 题型:填空题
由于催化剂可以为化学工业生产带来巨大的经济效益,催化剂研究和寻找一直是受到重视的高科技领域。
(1)V2O5是接触法制硫酸的催化剂。下图为硫酸生产过程中2SO2
(g) + O2(g)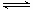 2SO3(g)
ΔH=-196.6 kJ·mol-1反应过程的能量变化示意图。
2SO3(g)
ΔH=-196.6 kJ·mol-1反应过程的能量变化示意图。
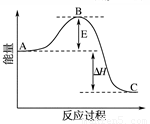
①V2O5的使用会使图中B点 (填“升高”、“降低”)。
②一定条件下,SO2与空气反应tmin后,SO2和SO3物质的量浓度分别为a mol/L和b mol/L,则SO2起始物质的量浓度为 mol/L;生成SO3的化学反应速率为 mol/(L·min)。
(2)下图是一种以铜、稀硫酸为原料生产蓝矾的生产流程示意图。
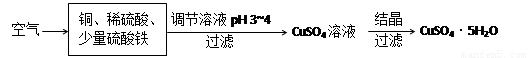
①生成CuSO4的总反应为2Cu+O2+2H2SO4=2 CuSO4+2H2O,少量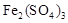 起催化作用,使反应按以下两步完成:
起催化作用,使反应按以下两步完成:
第一步:Cu+2Fe3+=2Fe2++Cu2+
第二步: 。(用离子方程式表示)
②调节溶液pH为3~4的目的是 ,调节时加入的试剂可以为 。(选填序号)
a.NaOH溶液 b.CuO粉末 c.Cu2(OH)2CO3 d.氨水
(3)纳米TiO2是优良的光敏催化剂。工业上用钛铁矿制得粗TiO2;再转化为TiCl4(l);由TiCl4(l)制取纳米TiO2的方法之一是将TiCl4气体导入氢氧火焰中(700~1000℃)进行水解。
已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
①写出TiO2和焦炭、氯气反应生成TiCl4和CO的热化学方程式: 。
②写出上述TiCl4(l)制取纳米TiO2的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
离子方程式正误判断专题(正确的选A,错误的选B)
过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O
苯酚钠溶液中通入少量:![]() -O-+CO2+H2O→
-O-+CO2+H2O→![]() -OH+HCO3-
-OH+HCO3-
FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
浓氢氧化钠溶液吸收少量SO2气体:SO2+2OH-=SO32-+H2O
硫酸铜溶液中通入硫化氢 Cu2++H2S=CuS↓+2H+
氯化铝溶液中加入过量氨水 Al3++4NH3·H2O=AlO2-+4NH4++2H2O
碳酸氢钠溶液中加入过量氢氧化钠溶液HCO3-+OH-=CO32-+H2O
向饱和碳酸氢钙溶液中加入饱和氢氧化钙溶液
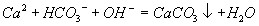
金属铝溶于氢氧化钠溶液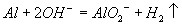
用氢氧化钠溶液吸收二氧化碳
Fe2(SO4)3的酸性溶液中通入足量硫化氢![]()
次氯酸钙溶液中通入过量二氧化碳Ca2++2ClO-+H2O+CO2 == CaCO3↓+2HClO
碳酸氢镁溶液中加入足量的烧碱溶液:Mg2++2HCO3-+2OH-=MgCO3↓+CO32-+2H2O
用氨水吸收少量二氧化硫:NH3·H2O+SO2 == NH![]() +HSO
+HSO![]()
硝酸铁溶液中加过量氨水:Fe3++3 NH3·H2O == Fe(OH)3↓+3NH![]()
硫化钠溶于水中 S2-+2H2O H2S↑+2OH-
实验室制取氯气 MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
铜与稀硝酸反应 3Cu+8H++2NO3—=3Cu2++2NO↑+4H2O
Ca(OH)2溶液中加入等物质的量的NaHCO3
Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
NaHCO3的水解:HCO3-+H2O H3O+ +CO32-
H3O+ +CO32-
金属铝溶于NaOH溶液:Al+2OH-=AlO2-+H2↑
钢铁吸氧腐蚀的正极反应式:4OH--4e-=O2+2H2O
硫酸亚铁溶液与过氧化氢溶液混合:Fe2++2H2O2+4H+=Fe3++4H2O
小苏打溶液与稀硫酸混合CO32-+2H+=CO2↑+H2O
大理石溶解于醋酸CaCO3+2H+=Ca2++CO2↑+H2O
三氯化铝溶液加热蒸干 Al3++3H2O=Al(OH)3↓+3H+
硫酸铝溶液中加入过量氨水 Al3++3OH—══Al(OH)3↓
电解饱和食盐水 2Cl—+2H2O H2↑+C12↑+20H—
H2↑+C12↑+20H—
碳酸钙与盐酸反应 CaCO3+2H+═Ca2++CO2↑ +H2O
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
非金属知识规律总结
【高考导航】
一、非金属元素在周期表中的位置和结构特点
1、除H外,非金属元素均在“阶梯线”的右上方。共有16种非金属元素,其中包括稀有气体元素6种。
2、非金属元素(包括稀有元素)均在主族(零族)。非金属元素一般都有变价。
3、最外层电子数一般≥4(H、B除外)。
4、原子半径比同周期金属半径小(稀有元素除外)。
二、非金属性强弱的判断依据
元素非金属性的本质是元素的原子吸引电子的能力。试题常通过以下几个方面来比较元素的非金属性:
1、单质跟H2化合难易程度(反应条件,剧烈程度,反应热的大小,生成气态氢化物的稳定性)。
2、最高价氧化物对应水化物的酸性。
3、化合物中元素化合价的正负,如BrCl中,Cl为-1价,Br为+1价,说明非金属性Cl>Br。
4、通过氧化还原反应确定非金属单质的氧化能力,进而比较非金属性。
需要指出的是,非金属单质的活动性与非金属元素的活动性,有密切的联系,但不是一回事。例如氮元素的非金属性相当强,可是它的单质N2化学性质却不很活泼。单质的化学性质不仅取决于原子结构,而且取决于分子结构和晶体结构。
三、非金属元素的性质及递变规律
1、单质:
(1)结构:除稀有气体外,非金属原子间以共价键结合。非金属单质的成键有明显的规律性。若它处在第N族,每个原子可提供8-N个价电子去和8-N个同种原子形成8-N个共价单键,可简称8-N规则;(H遵循2-N规则)。如ⅦA族单质:x-x;H的共价数为1,H-H,第ⅥA族的S、Se、Te共价单键数为8-6=2,第ⅤA族的P、As共价单键数8-5=3。但第二周期的非金属单质中N2、O2形成多键。
(2)熔沸点与聚集态。它们可以分为三类:
①小分子物质。如:H2、O2、N2、Cl2等,通常为气体,固体为分子晶体。
②多原子分子物质。如P4、S8、As4等,通常为液态或固态。均为分子晶体,但熔、沸点因范德华力较大而比①高,Br2、I2也属此类,一般易挥发或升华。
③原子晶体类单质。如金刚石、晶体硅和硼等,是非金属单质中高熔点“三角区”,通常为难挥发的固体。
(3)导电性:非金属一般属于非导体,金属是良导体,而锗、硅、砷、硒等属于半导体。但半导体与导体不同之处是导电率随温度升高而增大。
(4)化学活性及反应:

③非金属一般为成酸元素,难以与稀酸反应。 固体非金属能被氧化性酸氧化。

2、氢化物:
(1)气态氢化物性质比较
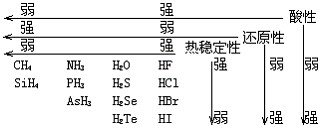
(2)由于氢键的存在,使得第ⅤA、ⅥA、ⅦA氢化物的熔沸点出现了反常。第ⅤA中:SbH3>NH3>AsH3>PH3;第ⅥA中: H2O>H2Te>H2Se>H2S;第ⅦA中HF>HI>HBr>HCl。
(3)气态氢化物水溶液的酸碱性及与水作用的情况。①HCl、HBr、HI溶于水成酸且都是强酸。②HF、H2S、H2Se、H2Te溶于水成酸且都是弱酸。③NH3溶于水成碱,氨水是弱碱。④PH3、AsH3、CH4与水不反应。⑤SiH4、B2H6与水作用时分解并放出H2。
3、非金属氧化物的通性:
(1)许多非金属低价氧化物有毒,如SO2、NO、NO2、CO等,注意不能随便排放于大气中。
(2)非金属氧化物(除SiO2外)大都是分子晶体,熔沸点相差不大。
(3)非金属氧化物大都为酸酐,相应的酸易溶于水,则氧化物易与水化合,反之水化反应难以进行。
(4)不成盐氧化物(如CO、NO)不溶于水,也不与碱反应。虽然NO2能与碱反应生成盐,但NO2不属于酸酐。
4、含氧酸
(1)同周期非金属元素最高价含氧酸从左到右酸性增强。
(2)氧化性:同种元素低价强于高价含氧酸.
如:HClO>HClO3>HClO4(稀)
H2SO3>H2SO4(稀)
HNO2>HNO3(稀)
(3)对于同种非金属形成的不同含氧酸,价态越高,酸性越强。其顺序如:HClO4>HClO3>HClO2>HClO,H2SO4>H2SO3。
(4)难挥发的H2SO4、H3PO4受热难分解;强氧化性的HNO3、HNO2、HClO见光或受热易分解;非氧化性的H2CO3、H2SO3易分解。强酸可制弱酸,难挥发性酸制挥发性酸。
(5)常见含氧酸的一般性质:
①H2SO4:无色粘稠的油状液体,强酸,沸点高,不挥发,稳定。浓硫酸有吸水性、脱水性和强氧化性。
②H2SO3:仅存在于溶液中,中强酸,不稳定。
③HClO4:在水溶液中相当稳定,最强无机酸,有强氧化性。
④HClO:仅存在于溶液中,是一种弱酸,有强氧化性和漂白性,极不稳定,遇光分解。⑤HNO3:无色液体,强酸,沸点低,易挥发,不稳定,易分解,有强氧化性。
⑥H3PO4:无色晶体,中强酸,难挥发,有吸水性,稳定,属于非氧化性酸。
⑦H2CO3:仅存在于溶液中,弱酸,不稳定。
⑧H2SiO3:白色固体,不溶于水,弱酸,不挥发,加热时可分解。
⑨常见酸的酸性强弱。强酸:HCl、HNO3、H2SO4;中强酸:H2SO3>H3PO4(H3PO4中强偏弱);弱酸:HF>CH3COOH>H2CO3>H2S>HClO>H2SiO3。
四、11种无机化学气体的制取和性质(O2、H2、Cl2、CO、NO、SO2、NO2、CO2、H2S、HCl、NH3)。
(1)利用氧化还原反应原理制取的气体有:O2、H2、Cl2、NO、NO2等。
(2)利用复分解制取的气体有:SO2、CO2、H2S、HCl、NH3等。
(3)可用启普发生器制取的气体有:H2、CO2、H2S等。
(4)只能用排气法收集的是:Cl2、SO2、NO2、CO2、H2S、HCl、NH3等。只能用排水法收集的气体是:NO、CO。
(5)使红色石蕊变蓝的气体是NH3;使石灰水变浑浊的气体是SO2和CO2;使品红溶液褪色的气体是SO2和Cl2;使高锰酸钾溶液和溴水褪色的气体有H2S和SO2。
(6)臭鸡蛋气味的气体是H2S;刺激性气味的气体有:Cl2、SO2、NO2、HCl、NH3等;毒性气体有:Cl2、CO、NO、SO2、NO2、H2S等。
(7)能在空气中燃烧的气体:H2S、CO、H2等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com