
 已知硫酸工业生产过程中涉及的化学反应有:
已知硫酸工业生产过程中涉及的化学反应有:| 2mol |
| 2L |
| 2mol |
| 2L |



 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
| A、Na→Na2O2→NaOH→Na2CO3?10H2O→Na2CO3 |
| B、Na→Na2O→NaOH→Na2CO3?10H2O→Na2CO3 |
| C、Na→Na2O2→NaOH→Na2CO3?10H2O→HaHCO3 |
| D、Na→Na2O→NaOH→Na2CO3?10H2O→NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
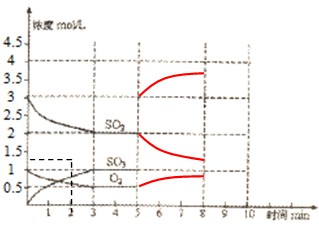
 Ⅰ.( 1)在一个体积为2L的密闭容器中充入6mol SO2和3mol O2,进行下列反应2SO2(g)+O2(g)?2SO3(g),保持温度不变,2min后达到平衡,测得混合气体中O2的体积分数为25%,用SO2浓度变化来表示的化学反应速率为
Ⅰ.( 1)在一个体积为2L的密闭容器中充入6mol SO2和3mol O2,进行下列反应2SO2(g)+O2(g)?2SO3(g),保持温度不变,2min后达到平衡,测得混合气体中O2的体积分数为25%,用SO2浓度变化来表示的化学反应速率为
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用棕色细口试剂瓶存放氯水 |
| B、NaOH溶液盛装在带橡皮塞的试剂瓶中 |
| C、漂白粉长期放置于敞口烧杯中 |
| D、FeSO4溶液存放在含少量铁粉的试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v1>v2 |
| B、v1<v2 |
| C、v1=v2 |
| D、不能确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com