
 苯乙烯(C6H5CH=CH2)2是合成橡胶和塑料的单体,用来生产丁苯橡胶、聚苯乙烯等.工业上以乙苯C6H5CH2CH3为原料,采用催化脱氢的方法制取苯乙烯,反应方程式为:C6H5CH2CH3(g)?C6H5CH=CH2(g)+H2(g)△H
苯乙烯(C6H5CH=CH2)2是合成橡胶和塑料的单体,用来生产丁苯橡胶、聚苯乙烯等.工业上以乙苯C6H5CH2CH3为原料,采用催化脱氢的方法制取苯乙烯,反应方程式为:C6H5CH2CH3(g)?C6H5CH=CH2(g)+H2(g)△H分析 (1)H2和CO的燃烧热(△H)分别为-285.8kJ.mol•L-1和-283.0kJ.mol•L-1,可得热化学方程式:
①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8KJ/mol,
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0KJ/mol,
已知③:C6H5CH2CH3(g)+CO2(g)?C6H5CH=CH2(g)+CO(g)+H2O(l)△H=+114.8kJ/mol,
根据盖斯定律,③+②-①可得:C6H5CH2CH3(g)?C6H5CH=CH2(g)+H2(g);
(2)A.升高温度,正逆反应速率均增大;
B.若继续加入1mol乙苯,等效为增大压强,平衡逆向移动;
C.压缩容器的体积,增大体系的压强,平衡向气体体积减小的方向移动,乙苯的浓度增大,平衡常数不变,故平衡时苯乙烯、氢气的浓度也增大;
D.相同条件下若起始加入1mol苯乙烯和1mol氢气,等效为开始加入1mol乙苯,与原平衡为完全等效平衡,平衡时乙苯的物质的量相等,再计算反应热;
(3)由图示可知:700℃时,乙苯的物质的量百分含量为20%,参加反应的乙苯为xmol,则:
C6H5CH2CH3(g)?C6H5CH=CH2(g)+H2(g)
起始量(mol):1 0 0
变化量(mol):x x x
平衡量(mol):1-x x x
再根据乙苯的物质的量分数列方程计算x,进而计算乙苯的转化率;
计算各组分平衡浓度,代入平衡常数表达式K=$\frac{c({C}_{6}{H}_{5}CH=C{H}_{2})×c({H}_{2})}{c({C}_{6}{H}_{5}C{H}_{2}C{H}_{3})}$计算;
有机物受热易分解,温度高于970℃时,可能是应有机物分解使苯乙烯的产率不再增加;
(4)由题目信息可知,阳极上整个过程是苯乙烯氧化生成二氧化碳,由守恒守恒可知,应有OH- 离子生成,由元素守恒可知,应有水参与反应;阴极上是氢离子获得电子生成氢气,阴极电极反应式为:2H2O+2e-=H2+2OH-,根据阳极反应式计算生成二氧化碳物质的量,根据电子转移守恒计算阴极生成氢气物质的量.
解答 解:(1)H2和CO的燃烧热(△H)分别为-285.8kJ.mol•L-1和-283.0kJ.mol•L-1,可得热化学方程式:
①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8KJ/mol,
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0KJ/mol,
已知③:C6H5CH2CH3(g)+CO2(g)?C6H5CH=CH2(g)+CO(g)+H2O(l)△H=+114.8kJ/mol,
根据盖斯定律,③+②-①可得:C6H5CH2CH3(g)?C6H5CH=CH2(g)+H2(g),故△H=114.8KJ/mol-283.0KJ/mol+285.8KJ/mol=+117.6KJ/mol,
故答案为:+117.6KJ/mol;
(2)A.温度变化对正逆反应速率的影响是一致的,只是改变的程度不同,所以升高温度,正反应速率和逆反应速率均增大,故A错误;
B.若继续加入1mol乙苯,相当于增大整个体系的压强,增大压强,平衡逆向移动,故苯乙烯转化率增大,B正确;
C.压缩容器的体积,增大体系的压强,平衡向气体体积减小的方向移动,乙苯的浓度增大,平衡常数不变,故平衡时苯乙烯、氢气的浓度也增大,故C错误;
D.相同条件下若起始加入1mol苯乙烯和1mol氢气,等效为开始加入1mol乙苯,与原平衡为完全等效平衡,平衡时乙苯的物质的量相等,假设平衡时为amol乙苯,则原平衡反应中能量变化为QkJ=(1-a)×△H kJ,而生成amol乙苯的能量变化为:a×△H kJ=(△H-Q)kJ,故D正确;
故答案为:BD;
(3)参加反应的乙苯为xmol,则:
C6H5CH2CH3(g)?C6H5CH=CH2(g)+H2(g)
起始量(mol):1 0 0
变化量(mol):x x x
平衡量(mol):1-x x x
由图示可知:700℃时,乙苯的物质的量百分含量为20%,则$\frac{1-x}{1-x+x+x}$=20%,所以x=$\frac{2}{3}$,乙苯的平衡转化率为$\frac{2}{3}$×100%=66.7%,
此温度下平衡常数K=$\frac{c({C}_{6}{H}_{5}CH=C{H}_{2})×c({H}_{2})}{c({C}_{6}{H}_{5}C{H}_{2}C{H}_{3})}$=$\frac{\frac{x}{2}×\frac{x}{2}}{\frac{1-x}{2}}$=$\frac{2}{3}$,
温度高于970℃时,苯乙烯的产率不再增加,可能有机物受热易分解是所致;
故答案为:66.7%;$\frac{2}{3}$;有机化合物在温度过高时分解;
(4)由题目信息可知,阳极上整个过程是苯乙烯氧化生成二氧化碳,由守恒守恒可知,应有OH- 离子生成,由元素守恒可知,应有水参与反应,阳极电极反应式为:C6H5CH=CH2+16H2O-40e-=8CO2↑+40H+,阴极上是氢离子获得电子生成氢气,阴极电极反应式为:2H2O+2e-=H2↑+2OH-,
除去0.5mol苯乙烯,则:
C6H5CH=CH2+16H2O-40e-=8CO2↑+40H+
0.5mol 20mol 4mol
2 H2O+2 e-=H2↑+2OH-
20mol 10mol
故两极共收集气体:4mol+10mol=14mol,
故答案为:C6H5CH=CH2+16H2O-40e-=8CO2↑+40H+;14.
点评 本题考查化学平衡计算及影响元素、反应热计算、电解原理应用等,(4)中电极反应式书写为易错点,综合考查学生阅读获取信息能力、应用知识分析解决问题能力,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 可用氧化物形式表示为BaO•CuO•2SiO2 | |
| B. | 性质稳定,不易脱色 | |
| C. | 易溶解于强酸和强碱 | |
| D. | x等于6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 一定含有Al,其质量为4.5g | |
| B. | 一定含有(NH4)2SO4和MgCl2,且物质的量相等 | |
| C. | 一定含有MgCl2和FeCl2 | |
| D. | 一定不含FeCl2,可能含有MgCl2和AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
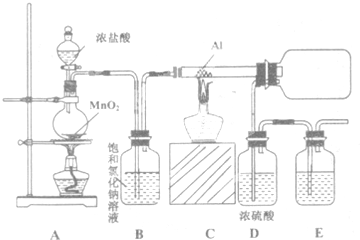
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
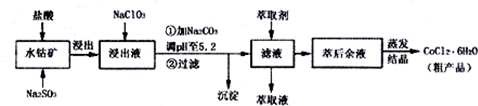
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
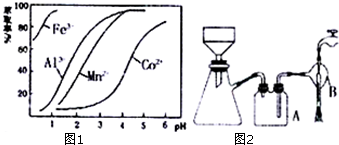
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 5min内平均反应速率vA=0.15mol•L-1•min-1 | |
| B. | 当同时对原平衡体系升高一定温度和增加一定压强时,达平衡后,C的物质的量分数为60%,则该反应的正反应为放热反应 | |
| C. | 保持其他条件不变,若起始时向容器中加入0.5molA、0.5molB、1.5molC,则反应将向逆反应方向进行 | |
| D. | t℃,向2L密闭、恒容容器中加入等物质的量的A和B,反应达到平衡状态时,C的物质的量分数仍为60%,则加入A的物质的量为1.6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
| A. | 该反应的正反应是吸热反应 | |
| B. | 100℃时,向体积为V1L的恒容密闭容器中充入2mol CO和4mol H2,达到平衡时,CO的转化率为40%,则V1=12 | |
| C. | 250℃时,向体积为V2L的恒容密闭容器中充入3mol CO和3mol H2,达到平衡时,混合气体中CO的体积分数为50% | |
| D. | 250℃时,向体积为V2L的恒容密闭容器中充入3mol CO和3mol H2,达到平衡时,混合气体中CH3OH(g)的体积分数为62.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 ml. | B. | 250 ml. | C. | 500 ml. | D. | 1 L. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com