
【题目】下列分子的立体构型,其中属于直线形分子的是( )
A. NH3B. CCl4C. H2OD. CO2
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】通常情况下,氯化钠、氯化铯、二氧化碳和二氧化硅的晶体结构分别如下图所示:
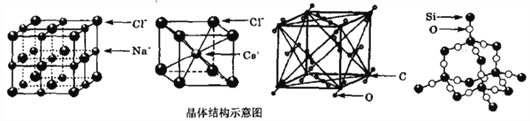
下列关于这些晶体结构和性质的叙述不正确的是( )
A. 在氯化钠晶体中每个Cl-周围同时吸引6个Na+,在氯化铯晶体中每个Cl-周围同时吸引8个Cs+
B. 氯化钠、氯化铯和二氧化碳的晶体都有立方的晶胞结构,它们具有相似的物理性质
C. 二氧化碳晶体是分子晶体,其中不仅存在分子间作用力,而且也存在共价键
D. 在二氧化硅晶体中,硅原子与氧原子个数比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列无色透明的各组离子中,在碱性溶液里能大量共存的是
A. K+、MnO4-、Cl-、SO42- B. Na+、SO42-、NO3-、Cl-
C. Na+、HCO3-、NO3-、SO42- D. Na+、K+、Cu2+、Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:下表为25℃时某些弱酸的电离平衡常数。
CH3COOH | HClO | H2CO3 |
Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
下图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是 ( )
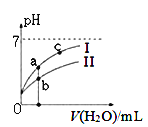
A. 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+) > c(ClO-)> c(CH3COO-)> c(OH-)> c(H+)
B. 向NaClO溶液中通入少量二氧化碳的离子方程式为: ClO-+CO2+ H2O =HClO+CO32-
C. 图像中a、c两点处的溶液中![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
D. 图像中a点酸的总浓度大于b点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属(M)﹣空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n,已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )

A. 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B. 在Mg﹣空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
C. M﹣空气电池放电过程的正极反应式:正极反应式为O2+2H2O+4e﹣=4OH﹣
D. 比较Mg、Al、Zn三种金属﹣空气电池,Mg﹣空气电池的理论比能量最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 工业上利用CO2生产甲醇燃料,反应方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH=-49.0 kJ·mol-1。将6 mol CO2和8 mol H2充入容积为2 L的密闭容器中(温度不变),H2的物质的量随时间变化如下图实线所示(图中字母后的数字表示对应坐标)。
CH3OH(g)+H2O(g)ΔH=-49.0 kJ·mol-1。将6 mol CO2和8 mol H2充入容积为2 L的密闭容器中(温度不变),H2的物质的量随时间变化如下图实线所示(图中字母后的数字表示对应坐标)。

①该反应在0-8 min内CO2的平均反应速率为_______。
②第12 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和3 mol H2O(g),则v正_____v逆(填“>”、“<”或“=”)。
③仅改变某一条件再进行实验,测得H2物质的量变化如上图虚线所示。与实线相比,曲线Ⅰ改变的条件可能是______,曲线Ⅱ改变的条件可能是________。
④在一定温度下,在容积为2L的两个相同密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物 投入量 | 1molCO2、3molH2 | xmolCO2、ymolH2、zmolCH3OH(g)、zmolH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则z的取值范围为______。
(2)①将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈_______性,该溶液中各离子浓度由大到小的顺序为:________________,所得溶液中c(H+)-c(OH-)=___________(填写表达式)(已知:H2SO3:Ka1=1.7×10﹣2,Ka2=6.0×10﹣8,NH3H2O:Kb=1.8×10﹣5)
②采用下图装置将SO2转化为重要化工原料。若A为SO2,B为O2,则A为_____极,该极电极反应式为_______________。
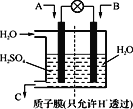
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的反应属于同一反应类型的是( )
A.苯的硝化反应;乙烯使溴水褪色
B.葡萄糖与新制氢氧化铜共热;无水乙醇与浓硫酸共热制乙烯
C.乙醇和乙酸制乙酸乙酯;乙烷和氯气得到氯乙烷
D.乙醇和氧气制乙醛;苯和液溴制溴苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧产生的SO2是引起酸雨的原因之一。
(1)每隔一定时间测定某处雨水样品的pH值:
![]()
雨水样品pH值变小的主要原因是____________________。
(2)反应2SO2(g)+O2(g)![]() 2SO3(g)+Q (Q>0),其化学平衡常数表达式_______;升高温度,K____________(填“变大”或者“变小”)。
2SO3(g)+Q (Q>0),其化学平衡常数表达式_______;升高温度,K____________(填“变大”或者“变小”)。
(3)判断已达到化学平衡状态的描述是______(选填编号)。
a.体系的压强不再发生变化 | b.2υ正(SO2)=υ逆(O2) |
c.c(SO2) = c(SO3) | d.气体总质量不再变化 |
(4)防治酸雨常用的措施:向煤中加石灰,减少 SO2的产生。这种煤燃烧后,大部分硫元素最终转化为固体盐是_____________。
(5)把CO2气体通入澄清的石灰水,立即会产生浑浊,但把SO2气体通入澄清的石灰水,却不容易看到浑浊,而CaCO3和CaSO3都是难溶的电解质,试说明原因:_____________________。
(6)Na2SO3溶液呈碱性,可吸收尾气SO2。Na2SO3溶液呈碱性的原因(用离子方程式表示)_____________________;常温下,0.1mol/L该溶液中离子浓度由大到小排列___________(用离子符号表示)。
(7)常温下,NaHSO3溶液呈酸性,在Na2SO3溶液中滴加稀盐酸至中性时,溶质的主要成分有__________________。(用化学式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com