
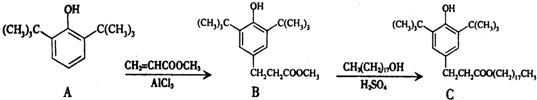
| A. | 物质A是苯甲醇的同系物 | |
| B. | 物质B能发生取代、加聚等反应 | |
| C. | 可用氯化铁溶液鉴别物质C中是否含有CH3(CH2)17OH杂质 | |
| D. | 1 mol物质C与足量NaOH溶液反应,最多可消耗2 mol NaOH |
分析 A.A属于酚类物质;
B.B中含有苯环、酚羟基和酯基,具有苯、酚和酯的性质;
C.C中含有酚羟基,CH3(CH2)17OH中含有醇羟基,酚能发生显色反应;
D.能和NaOH反应的有酚羟基和酯基水解生成的羧基.
解答 解:A.A中含有酚羟基,属于酚类物质,不属于醇,所以与苯甲醇不是同系物,故A错误;
B.B中含有苯环、酚羟基和酯基,具有苯、酚和酯的性质,能发生加成反应、取代反应、水解反应,但不能发生加聚反应,故B错误;
C.C中含有酚羟基,CH3(CH2)17OH中含有醇羟基,酚能发生显色反应,用氯化铁能检验C,但不能检验CH3(CH2)17OH,故C错误;
D.能和NaOH反应的有酚羟基和酯基水解生成的羧基,所以1 mol物质C与足量NaOH溶液反应,最多可消耗2 mol NaOH,故D正确;
故选D.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断能力,涉及基本概念、物质检验等知识点,易错选项是D.


科目:高中化学 来源: 题型:选择题
| A. | m:n:w=3:1:2 | |
| B. | 体积和温度不变时,若在前10s内A减少了x mol,则B在前20s内减少$\frac{2x}{3}$ mol | |
| C. | 体积和温度不变时,随反应进行压强逐渐下降,一段时间后压强保持恒定不变 | |
| D. | 单位时间内反应物浓度的减少大于生成物浓度的增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ•mol-1 | 738 | 1451 | 7733 | 10540 | 13630 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮的化合物在农业、国防工业、航天工业等领域有广泛的用途.
氮的化合物在农业、国防工业、航天工业等领域有广泛的用途.| 氢氧化物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
| Ksp | 2.2×10-20 | 4.0×10-38 | 8.0×10-16 | 1.8×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可能呈酸性 | B. | 不可能呈碱性 | ||
| C. | 可能呈中性或碱性 | D. | 不可能呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | S2Cl2做氧化剂,H2O做还原剂 | |
| B. | 每生成l mol SO2转移4 mol电子 | |
| C. | 氧化产物与还原产物的物质的量之比为l:3 | |
| D. | 每生成48g硫会断裂2mol氢氧键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 污染 | 废旧热固性塑料 | 煤燃烧 | 含Hg2+的工业废水 | 生活垃圾 |
| 方法 | 粉碎作为填充剂 | 煤中加入适量石灰石 | 加入Na2S溶液 | 焚烧发电 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞呈红色的溶液:Na+、NO3-、Ba2+、Br- | |
| B. | 加水稀释pH减小的溶液:K+、Al3+、Cl-、CH3COO- | |
| C. | 含有大量Fe(NO3)2的溶液:NH4+、H+、SO42-、I- | |
| D. | c(OH-)<$\sqrt{{K}_{w}}$的溶液:ClO-、NO3-、Na+、Ca2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com